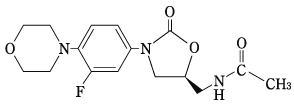
オキサゾリジノン系合成抗菌剤
1袋 6712円
| 剤形・性状 | 水性注射剤 無色〜黄色澄明の液 |
|---|---|
| pH | 4.4〜5.2 |
| 浸透圧比(生理食塩液に対する比) | 約1 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| モノアミン酸化酵素(MAO)阻害剤(塩酸セレギリン) | 両薬剤が相加的に作用し血圧上昇等があらわれるおそれがある。 | 本剤は非選択的、可逆的MAO阻害作用を有する。 |
| アドレナリン作動薬(ドパミン塩酸塩、アドレナリン、フェニルプロパノールアミン等) | 血圧上昇、動悸があらわれることがあるので、患者の状態を観察しながら、これらの薬剤の初回量を減量するなど用量に注意すること。 | 本剤は非選択的、可逆的MAO阻害作用を有する。 |
| *セロトニン作動薬(炭酸リチウム、セロトニン・ノルアドレナリン再取り込み阻害剤(SNRI)、選択的セロトニン再取り込み阻害剤(SSRI)、トリプタン系薬剤、L-トリプトファン含有製剤、トラマドール塩酸塩、フェンタニル、メサドン塩酸塩、ペチジン塩酸塩等) | セロトニン症候群の徴候及び症状(錯乱、せん妄、情緒不安、振戦、潮紅、発汗、超高熱)があらわれるおそれがあるので、十分に注意すること。 これらの徴候や症状が認められた場合には、本剤と併用薬の両方あるいはいずれか一方の投与を中止するなど適切な処置を行うこと。なお、セロトニン作動薬の急激な減量又は投与中止により離脱症状があらわれることがあるので注意すること。 | 本剤は非選択的、可逆的MAO阻害作用を有する。 |
| リファンピシン | リファンピシンとの併用により本剤のCmax及びAUCがそれぞれ21%及び32%低下した。 | 機序不明 |
| チラミンを多く含有する飲食物(チーズ、ビール、赤ワイン等注)) | 血圧上昇、動悸があらわれることがあるので、本剤投与中には、チラミン含有量の高い飲食物の過量摂取(1食あたりチラミン100mg以上)を避けさせること。 | 本剤は非選択的、可逆的MAO阻害作用を有する。 |