| 剤形 | 楕円形の割線入りフィルムコーティング錠 |
|---|---|
| 色調 | 黄色 |
| 外形 | |
| 表面 |  |
| 裏面 |  |
| 側面 |  |
| 直径(mm) | 13.6×6.6 |
| 厚さ(mm) | 4.1 |
| 質量(mg) | 335 |
| 本体コード | 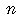 972 972 |
| 包装コード | 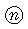 972 972 |
| 剤形 | 楕円形の割線入りフィルムコーティング錠 |
|---|---|
| 色調 | うすいだいだい色 |
| 外形 | |
| 表面 | 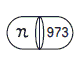 |
| 裏面 |  |
| 側面 |  |
| 直径(mm) | 16.2×7.9 |
| 厚さ(mm) | 5.6 |
| 質量(mg) | 670 |
| 本体コード | 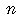 973 973 |
| 包装コード | 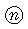 973 973 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| フェニル酢酸系又はプロピオン酸系非ステロイド性消炎鎮痛薬 フルルビプロフェン等 | 痙攣を起こすおそれがある。 | 中枢神経におけるGABAA受容体への結合阻害が増強されると考えられている。 |
| アルミニウム又はマグネシウム含有の制酸薬等,鉄剤 | 本剤の効果が減弱されるおそれがある。 これらの薬剤は本剤投与から1〜2時間後に投与する。 | これらの薬剤とキレートを形成し,本剤の吸収が低下すると考えられている。 |
| クマリン系抗凝固薬 ワルファリン | ワルファリンの作用を増強し,プロトロンビン時間の延長が認められたとの報告がある。 | ワルファリンの肝代謝を抑制,又は蛋白結合部位での置換により遊離ワルファリンが増加する等と考えられている。 |
| QT延長を起こすことが知られている薬剤 デラマニド等 | QT延長を起こすおそれがある。 | 併用によりQT延長作用が相加的に増加するおそれがある。 |
| *副腎皮質ホルモン剤(経口剤及び注射剤) プレドニゾロン ヒドロコルチゾン等 | 腱障害のリスクが増大するとの報告がある。これらの薬剤との併用は,治療上の有益性が危険性を上回る場合のみとすること。 | 機序不明 |
| 頻度不明 | |
| 過敏症 | 発疹,そう痒症,蕁麻疹,光線過敏症 |
| *精神神経系 | 不眠,めまい,頭痛,傾眠,しびれ感,振戦,ぼんやり,幻覚,意識障害,錐体外路障害 |
| 泌尿器 | クレアチニン上昇,血尿,BUN上昇,尿蛋白陽性,頻尿,尿閉,無尿 |
| 肝臓 | AST(GOT)上昇,ALT(GPT)上昇,LDH上昇,肝機能異常,ALP上昇,γ−GTP上昇,血中ビリルビン増加 |
| 血液 | 白血球数減少,好酸球数増加,好中球数減少,リンパ球数減少,血小板数減少,貧血 |
| 消化器 | 悪心,嘔吐,下痢,腹部不快感,腹痛,食欲不振,消化不良,口渇,腹部膨満,胃腸障害,便秘,口内炎,舌炎 |
| 感覚器 | 耳鳴,味覚異常,味覚消失,視覚異常,無嗅覚,嗅覚錯誤 |
| 循環器 | 動悸,低血圧,頻脈 |
| その他 | CK(CPK)上昇,関節痛注),胸部不快感,倦怠感,四肢痛,咽喉乾燥,尿中ブドウ糖陽性,高血糖,熱感,浮腫,筋肉痛,脱力感,発熱,関節障害,発汗,胸痛 |