キャンディン系抗真菌剤
1瓶 2603円
| 形状 | 塊(凍結乾燥品) |
|---|---|
| 色 | 白色 |
| 含量/溶解液量(溶解液) | pH | 浸透圧比 |
| 50mg(力価)/100mL(生理食塩液) | 4.5〜8.0 | 約1 |
| 75mg(力価)/100mL(生理食塩液) | 4.5〜8.0 | 約1 |
| 150mg(力価)/100mL(生理食塩液) | 4.5〜8.0 | 約1 |
| 300mg(力価)/100mL(生理食塩液) | 4.5〜8.0 | 約1 |
| 50mg(力価)/100mL(ブドウ糖注射液(5w/v%)) | 3.5〜7.0 | 約1 |
| 75mg(力価)/100mL(ブドウ糖注射液(5w/v%)) | 3.5〜7.0 | 約1 |
| 150mg(力価)/100mL(ブドウ糖注射液(5w/v%)) | 3.5〜7.0 | 約1 |
| 300mg(力価)/100mL(ブドウ糖注射液(5w/v%)) | 3.5〜7.0 | 約1 |
| 形状 | 塊(凍結乾燥品) |
|---|---|
| 色 | 白色 |
| 含量/溶解液量(溶解液) | pH | 浸透圧比 |
| 50mg(力価)/100mL(生理食塩液) | 4.5〜8.0 | 約1 |
| 75mg(力価)/100mL(生理食塩液) | 4.5〜8.0 | 約1 |
| 150mg(力価)/100mL(生理食塩液) | 4.5〜8.0 | 約1 |
| 300mg(力価)/100mL(生理食塩液) | 4.5〜8.0 | 約1 |
| 50mg(力価)/100mL(ブドウ糖注射液(5w/v%)) | 3.5〜7.0 | 約1 |
| 75mg(力価)/100mL(ブドウ糖注射液(5w/v%)) | 3.5〜7.0 | 約1 |
| 150mg(力価)/100mL(ブドウ糖注射液(5w/v%)) | 3.5〜7.0 | 約1 |
| 300mg(力価)/100mL(ブドウ糖注射液(5w/v%)) | 3.5〜7.0 | 約1 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| シロリムス | 本剤との併用によりシロリムスのAUCが21%上昇したとの報告がある。併用する場合は患者の状態を慎重に観察し、シロリムスの副作用発現に注意し必要に応じてシロリムスの投与量を調節すること。 | 機序不明 |
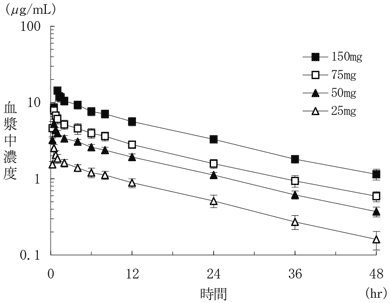
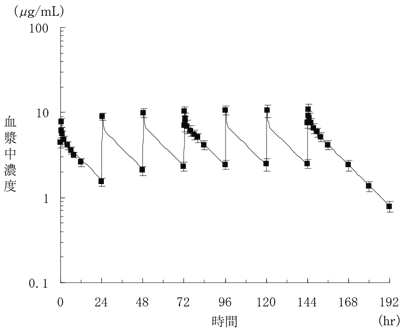
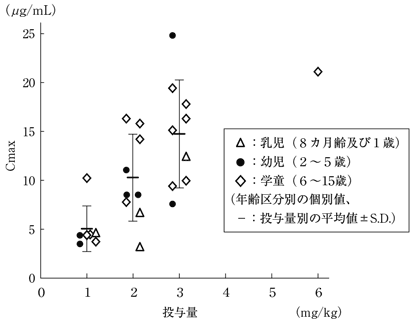
| 投与量 (mg) | 例数 | Cmax (μg/mL) | Tmax (hr) | AUC0-∞ (μg・hr/mL) | T1/2 (hr) |
| 25 | 6 | 2.52±0.28 | 0.5±0 | 34.3±5.8 | 14.0±1.2 |
| 50 | 6 | 5.23±0.38 | 0.5±0 | 74.3±6.2 | 14.2±1.2 |
| 75 | 6 | 7.90±1.35 | 0.5±0 | 106.5±13.4 | 13.3±0.7 |
| 150 | 5 | 14.30±1.31 | 1.0±0 | 216.6±23.1 | 14.0±0.9 |
| 25〜150 | 23 | − | − | − | 13.9±1.0 |
| 投与量 (mg/ | 例数 | Cmax (μg/mL) | T1/2 (hr) |
| 1 | 7 | 5.03±2.33 | 13.0±1.8 |
| 2 | 9 | 10.25±4.45 | 12.3±1.9 |
| 3 | 9 | 14.76±5.52 | 14.4±3.2※ |
| 6 | 1 | 21.11 | 11.3 |
| 1〜6 | 26 | − | 13.1±2.4 |
| 体重 (g) | 投与量 (mg/ | 例数 | Cmax (μg/mL) | AUC0-24hr (μg・hr/mL) | CLt (mL/min/ | T1/2※2 (hr) |
| 500-1000 | 0.75 | 4 | 1.31±0.31 | 8.8±1.4 | 1.32±0.21 | 5.5 |
| >1000 | 0.75 | 6 | 2.53±0.92 | 16.5±9.0 | 0.97±0.82 | 8.0 |
| >1000 | 1.5 | 6 | 4.51±1.34 | 44.1±24.0 | 0.64±0.15※1 | 7.8※1 |
| >1000 | 3 | 6 | 9.28±5.31 | 59.5±29.0 | 1.19±1.32 | 8.2 |
| 投与量 | 例数 | Cmax (μg/mL) | AUC0-24hr (μg・hr/mL) | T1/2 (hr) |
| 米国 (mg) 12.5 | 7 | 3.9±7.3 | 15.6±11.6 | 9.9±1.8 |
| 米国 (mg) 25 | 8 | 4.8±2.7 | 24.4±7.5 | 13.8±4.0 |
| 米国 (mg) 50 | 7 | 6.4±5.7 | 49.0±11.1 | 12.5±2.6 |
| 米国 (mg) 75 | 8 | 8.3±4.8 | 66.1±20.6 | 13.2±4.4 |
| 米国 (mg) 100 | 7 | 28.2±22.9 | 110.0±31.8 | 13.9±3.1 |
| 米国 (mg) 150 | 8 | 17.6±8.4 | 166.4±49.3 | 13.1±2.5 |
| 米国 (mg) 200 | 8 | 26.5±20.7 | 208.3±65.5 | 15.9±4.8 |
| 英国 (mg/ 3 | 8 | 21.1±2.8 | 234±33.6 | 14.0±1.4 |
| 英国 (mg/ 4 | 10 | 29.2±6.2 | 339±72.2 | 14.2±3.2 |
| 英国 (mg/ 6 | 8 | 38.4±6.9 | 479±157 | 14.9±2.6 |
| 英国 (mg/ 8 | 8 | 60.8±26.9 | 663±212 | 17.2±2.3 |
| 菌種 | 疾患名 | 有効例/症例数 | 有効率(%) |
| アスペルギルス属 | 侵襲性肺アスペルギルス症 | 6/10 | 60.0 |
| アスペルギルス属 | 慢性壊死性肺アスペルギルス症 | 6/8 | − |
| アスペルギルス属 | 肺アスペルギローマ | 10/16 | 62.5 |
| アスペルギルス属 | 小計 | 22/34 | 64.7 |
| カンジダ属 | カンジダ血症 | 3/3 | − |
| カンジダ属 | 食道カンジダ症 | 5/5 | − |
| カンジダ属 | 小計 | 8/8 | − |
| 合計 | 合計 | 30/42 | 71.4 |
| 疾患名 | 有効例/症例数 | 有効率(%) |
| アスペルギルス症 | 92/130 | 70.8 |
| カンジダ症 | 390/452 | 86.3 |
| 菌種 | 疾患名 | 有効例/症例数 | 有効率(%) |
| アスペルギルス属 | 侵襲性肺アスペルギルス症 | 2/2 | − |
| アスペルギルス属 | 侵襲性肺アスペルギルス症(疑)※1 | 1/1 | − |
| アスペルギルス属 | 小計 | 3/3 | − |
| カンジダ属 | カンジダ血症 | 1/2 | − |
| カンジダ属 | カンジダ血症(疑)※2 | 4/5 | − |
| カンジダ属 | 肺カンジダ症(疑)※3 | 2/3 | − |
| カンジダ属 | 小計 | 7/10 | 70.0 |
| 合計 | 合計 | 10/13 | 76.9 |
| 菌種 | 疾患名 | 有効例/症例数 | 有効率(%) |
| アスペルギルス属 | 侵襲性肺アスペルギルス症 | 1/3 | − |
| アスペルギルス属 | アスペルギルス血症 | 2/2 | − |
| アスペルギルス属 | 小計 | 3/5 | − |
| カンジダ属 | カンジダ血症 | 8/12 | 66.7 |
| カンジダ属 | 食道カンジダ症 | 4/4 | − |
| カンジダ属 | 小計 | 12/16 | 75.0 |
| 合計 | 合計 | 15/21 | 71.4 |