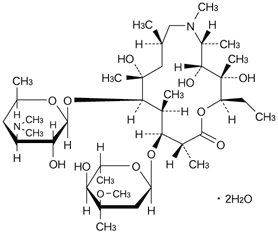
15員環マクロライド系抗生物質製剤
1錠 46.7円
| 性状 | 淡黄白色の細粒で、においはないか又はわずかに特異なにおいがあり、味は甘い。 |
|---|
| 性状 | 白色のフィルムコーティング錠 |
|---|---|
| 外形 表面 直径 |  |
| 裏面 重さ |  |
| 側面 厚さ |  |
| 識別コード | TTS-700 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| 制酸剤(水酸化マグネシウム、水酸化アルミニウム) | 本剤の最高血中濃度低下の報告がある2)。 | 機序不明 |
| ワルファリン | 国際標準化プロトロンビン比上昇の報告がある3,4)。 | マクロライド系薬剤はワルファリンの肝臓における主たる代謝酵素であるチトクロームP450を阻害するので、ワルファリンの作用が増強することがあるが、本剤での機序の詳細は明らかではない。 |
| シクロスポリン | シクロスポリンの最高血中濃度の上昇及び血中濃度半減期の延長の報告がある。 | マクロライド系薬剤はシクロスポリンの主たる代謝酵素であるチトクロームP450を阻害するので、シクロスポリンの血中濃度が上昇することがあるが、本剤での機序の詳細は明らかではない。 |
| メシル酸ネルフィナビル | 本剤の1200mg投与で、本剤の濃度・時間曲線下面積(AUC)及び平均最高血中濃度の上昇の報告がある5)。 | 機序不明 |
| ジゴキシン | 本剤との併用により、ジゴキシン中毒の発現リスク上昇の報告がある6)。 | P-糖蛋白質を介したジゴキシンの輸送が阻害されることにより、ジゴキシンの血中濃度が上昇することを示唆した報告があるが、本剤での機序の詳細は明らかではない。 |
| **ベネトクラクス | ベネトクラクスの効果が減弱するおそれがあるので、併用を避けることが望ましい。 | 機序は不明であるが、ベネトクラクスの血中濃度が低下する可能性がある。 |
| (2) 他のマクロライド系薬剤において、下記薬剤による相互作用が報告されている。 なお、本剤のチトクロームP450による代謝は確認されていない。 | 1) テオフィリン、ミダゾラム、トリアゾラム、カルバマゼピン、フェニトイン[これらの薬剤の血中濃度が上昇し、作用が増強されるおそれがある。] 2) エルゴタミン含有製剤[四肢の虚血を起こすことがある。] | |
| (3) 他の抗菌剤との相互作用 | 本剤と他の抗菌剤との相互作用に関しては、これまでの国内又は外国における他社の臨床試験成績から、マクロライド系、ペニシリン系、キノロン系、テトラサイクリン系、セフェム系及びカルバペネム系抗菌剤との間で相互作用によると考えられる有害事象の報告はない。しかしながら、本剤の組織内濃度持続時間は長く、投与終了後も他の抗菌剤との間に相加作用又は相乗作用の可能性は否定できないので、本剤投与後に切り替える場合には、観察を十分に行うなど注意すること。 |