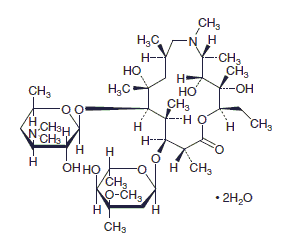
15員環マクロライド系抗生物質製剤
1錠 64.7円
| 剤形 | フィルムコーティング錠 |
|---|---|
| 色調 | 白色 |
| 外形 | |
| 表面 |  |
| 裏面 |  |
| 側面 |  |
| 直径(mm) | 12.6×6.4 |
| 厚さ(mm) | 4.9 |
| 質量(mg) | 298 |
| 本体コード |  789 789250 |
| 包装コード |  789 789 |
| 剤形 | フィルムコーティング錠 |
|---|---|
| 色調 | 白色 |
| 外形 | |
| 表面 |  |
| 裏面 |  |
| 側面 |  |
| 直径(mm) | 15.7×7.9 |
| 厚さ(mm) | 6.4 |
| 質量(mg) | 592 |
| 本体コード |  790 790500 |
| 包装コード |  790 790 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| 制酸剤 水酸化マグネシウム, 水酸化アルミニウム | 本剤の最高血中濃度低下の報告がある2)。 | 機序不明 |
| ワルファリン | 国際標準化プロトロンビン比上昇の報告がある3,4)。 | マクロライド系薬剤はワルファリンの肝臓における主たる代謝酵素であるチトクロームP450を阻害するので,ワルファリンの作用が増強することがあるが,本剤での機序の詳細は明らかではない。 |
| シクロスポリン | シクロスポリンの最高血中濃度の上昇及び血中濃度半減期の延長の報告がある。 | マクロライド系薬剤はシクロスポリンの主たる代謝酵素であるチトクロームP450を阻害するので,シクロスポリンの血中濃度が上昇することがあるが,本剤での機序の詳細は明らかではない。 |
| メシル酸ネルフィナビル | 本剤の1200mg投与で,本剤の濃度・時間曲線下面積(AUC)及び平均最高血中濃度の上昇の報告がある5)。 | 機序不明 |
| ジゴキシン | 本剤との併用により,ジゴキシン中毒の発現リスク上昇の報告がある6)。 | P-糖蛋白質を介したジゴキシンの輸送が阻害されることにより,ジゴキシンの血中濃度が上昇することを示唆した報告があるが,本剤での機序の詳細は明らかではない。 |
| **ベネトクラクス | ベネトクラクスの効果が減弱するおそれがあるので,併用を避けることが望ましい。 | 機序は不明であるが,ベネトクラクスの血中濃度が低下する可能性がある。 |
| (2)他のマクロライド系薬剤において,下記薬剤による相互作用が報告されている。 なお,本剤のチトクロームP450による代謝は確認されていない。 | 1)テオフィリン,ミダゾラム,トリアゾラム,カルバマゼピン,フェニトイン[これらの薬剤の血中濃度が上昇し,作用が増強されるおそれがある。] 2)エルゴタミン含有製剤[四肢の虚血を起こすことがある。] | |
| (3)他の抗菌剤との相互作用 | 本剤と他の抗菌剤との相互作用に関しては,これまでの国内又は外国における臨床試験成績から,マクロライド系,ペニシリン系,キノロン系,テトラサイクリン系,セフェム系及びカルバペネム系抗菌剤との間で相互作用によると考えられる有害事象の報告はない。しかしながら,本剤の組織内濃度持続時間は長く,投与終了後も他の抗菌剤との間に相加作用又は相乗作用の可能性は否定できないので,本剤投与後に切り替える場合には観察を十分に行うなど注意すること。 |
| 頻度不明 | |
| 皮膚注1) | 発疹,蕁麻疹,そう痒症,アトピー性皮膚炎増悪,光線過敏性反応,紅斑,水疱,皮膚剥離,多形紅斑,寝汗,多汗症,皮膚乾燥,皮膚変色,脱毛 |
| 血液 | 好酸球数増加,白血球数減少注2),血小板数増加,好塩基球数増加,顆粒球数減少注2),プロトロンビン時間延長,血小板数減少,貧血,リンパ球数減少,ヘモグロビン減少,白血球数増加 |
| 血管障害 | 血栓性静脈炎,潮紅 |
| 循環器 | 血圧低下,動悸,血圧上昇 |
| 肝臓 | ALT(GPT)増加,AST(GOT)増加,Al-P増加,γ-GTP増加,LDH増加,肝機能検査異常,血中ビリルビン増加 |
| 腎臓 | BUN増加,尿中蛋白陽性,クレアチニン増加,腎臓痛,排尿困難,尿潜血陽性,頻尿 |
| 消化器 | 下痢注2),腹痛,悪心,嘔吐,腹部不快感,腹部膨満,便秘,口内炎,消化不良,食欲不振,鼓腸放屁,口唇のあれ,黒毛舌,舌炎,舌苔,腹鳴,舌変色,口・舌のしびれ感,おくび,胃炎,口内乾燥,唾液増加,膵炎,アフタ性口内炎,口腔内不快感,消化管障害,口唇炎 |
| 精神・神経系 | 頭痛,めまい,灼熱感,傾眠,味覚異常,感覚鈍麻,不眠症,失神,痙攣,振戦,激越注2),嗅覚異常,無嗅覚,神経過敏,不安,錯感覚,攻撃性 |
| 感染症 | カンジダ症,胃腸炎,真菌感染,咽頭炎,皮膚感染,肺炎,β溶血性レンサ球菌感染,膣炎 |
| 眼 | 結膜炎,眼瞼浮腫,霧視,ぶどう膜炎,眼痛,視力障害 |
| 筋骨格系 | 筋肉痛,関節痛,頚部痛,背部痛,四肢痛,関節腫脹 |
| 呼吸器 | 咳嗽,呼吸困難,嗄声,鼻出血,アレルギー性鼻炎,くしゃみ,ラ音,気管障害,低音性連続性ラ音,鼻部障害,鼻閉,鼻漏,羊鳴性気管支音,痰貯留 |
| 耳 | 耳痛,難聴,耳鳴,聴力低下,耳の障害 |
| 生殖器 | 卵巣嚢腫,精巣痛,不正子宮出血 |
| 代謝 | 血中カリウム減少,血中カリウム増加,脱水,血中重炭酸塩減少,低カリウム血症 |
| 注入部位 | 疼痛,血管外漏出,紅斑 |
| その他 | 発熱,口渇,気分不良,倦怠感,浮遊感,胸痛,無力症,浮腫,低体温,不整脈,咽喉頭異物感,局所腫脹,粘膜異常感覚,疼痛,疲労 |
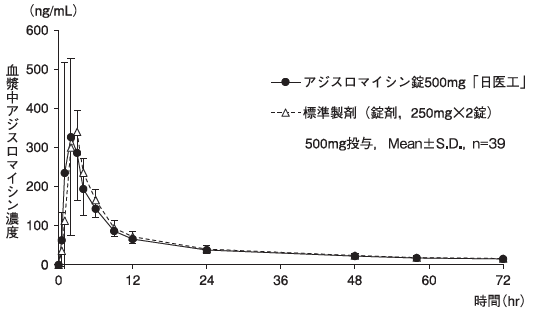
| 判定パラメータ AUC0→72 (ng・hr/mL) | 判定パラメータ Cmax (ng/mL) | 参考パラメータ Tmax (hr) | 参考パラメータ t1/2 (hr) | |
| アジスロマイシン錠500mg「日医工」 | 3606±983 | 472.67±222.72 | 2.13±0.83 | 36.15±11.09 |
| 標準製剤 (錠剤,250mg×2錠) | 3805±910 | 467.83±168.98 | 2.49±0.97 | 37.64±16.86 |