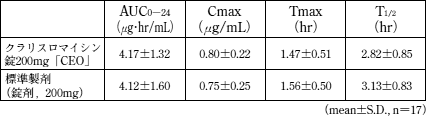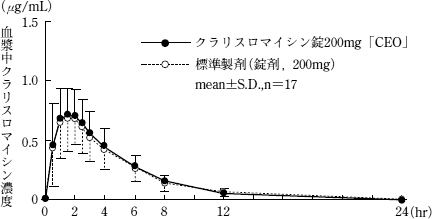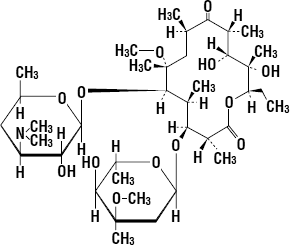

| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| **ピモジド オーラップ | QT延長,心室性不整脈(Torsade de pointesを含む)等の心血管系副作用が報告されている. | 本剤のCYP3Aに対する阻害作用により,上記薬剤の代謝が阻害され,それらの血中濃度が上昇する可能性がある. |
| エルゴタミン(エルゴタミン酒石酸塩,ジヒドロエルゴタミンメシル酸塩)含有製剤 クリアミン | 血管攣縮等の重篤な副作用を起こすおそれがある. | 本剤のCYP3Aに対する阻害作用により,上記薬剤の代謝が阻害され,それらの血中濃度が上昇する可能性がある. |
| スボレキサント ベルソムラ | スボレキサントの血漿中濃度が顕著に上昇し,その作用が著しく増強するおそれがある. | 本剤のCYP3Aに対する阻害作用により,上記薬剤の代謝が阻害され,それらの血中濃度が上昇する可能性がある. |
| ロミタピドメシル酸塩 ジャクスタピッド | ロミタピドメシル酸塩の血中濃度が著しく上昇するおそれがある. | 本剤のCYP3Aに対する阻害作用により,上記薬剤の代謝が阻害され,それらの血中濃度が上昇する可能性がある. |
| タダラフィル アドシルカ | 上記薬剤のクリアランスが高度に減少し,その作用が増強するおそれがある. | 本剤のCYP3Aに対する阻害作用により,上記薬剤の代謝が阻害され,それらの血中濃度が上昇する可能性がある. |
| チカグレロル ブリリンタ | チカグレロルの血漿中濃度が著しく上昇するおそれがある. | 本剤のCYP3Aに対する阻害作用により,上記薬剤の代謝が阻害され,それらの血中濃度が上昇する可能性がある. |
| イブルチニブ イムブルビカ | イブルチニブの血中濃度が上昇し,その作用が増強するおそれがある. | 本剤のCYP3Aに対する阻害作用により,上記薬剤の代謝が阻害され,それらの血中濃度が上昇する可能性がある. |
| イバブラジン塩酸塩 コララン | 過度の徐脈があらわれることがある. | 本剤のCYP3Aに対する阻害作用により,上記薬剤の代謝が阻害され,それらの血中濃度が上昇する可能性がある. |
| *ベネトクラクス(再発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含む)の用量漸増期) ベネクレクスタ | 腫瘍崩壊症候群の発現が増強するおそれがある. | 本剤のCYP3Aに対する阻害作用により,上記薬剤の代謝が阻害され,それらの血中濃度が上昇する可能性がある. |
| **,*ルラシドン塩酸塩 ラツーダ | ルラシドンの血中濃度が上昇し,作用が増強するおそれがある. | 本剤のCYP3Aに対する阻害作用により,上記薬剤の代謝が阻害され,それらの血中濃度が上昇する可能性がある. |
| **,*アナモレリン塩酸塩 エドルミズ | アナモレリンの血中濃度が上昇し,副作用の発現が増強するおそれがある. | 本剤のCYP3Aに対する阻害作用により,上記薬剤の代謝が阻害され,それらの血中濃度が上昇する可能性がある. |
| **フィネレノン ケレンディア | フィネレノンの血中濃度が著しく上昇するおそれがある. | 本剤のCYP3Aに対する阻害作用により,上記薬剤の代謝が阻害され,それらの血中濃度が上昇する可能性がある. |
| **イサブコナゾニウム硫酸塩 クレセンバ | イサブコナゾールの血中濃度が上昇し作用が増強するおそれがある. | 本剤のCYP3Aに対する阻害作用により,上記薬剤の代謝が阻害され,それらの血中濃度が上昇する可能性がある. |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| ジゴキシン | 嘔気,嘔吐,不整脈等が報告されているので,ジゴキシンの血中濃度の推移,自覚症状,心電図等に注意し,異常が認められた場合には,投与量を調節する等の適切な処置を行うこと. | 本剤の腸内細菌叢に対する影響により,ジゴキシンの不活化が抑制されるか,もしくはP-糖蛋白質を介したジゴキシンの輸送が阻害されることにより,その血中濃度が上昇する. |
| スルホニル尿素系血糖降下剤 グリベンクラミド等 | 低血糖(意識障害に至ることがある)が報告されているので,異常が認められた場合には,投与を中止し,ブドウ糖の投与等の適切な処置を行うこと. | 機序は明確ではないが,本剤との併用により,上記薬剤の血中濃度が上昇する可能性がある. |
| カルバマゼピン テオフィリン アミノフィリン水和物 シクロスポリン タクロリムス水和物 エベロリムス | 上記薬剤の血中濃度上昇に伴う作用の増強等の可能性があるので,上記薬剤の血中濃度の推移等に注意し,異常が認められた場合には,投与量の調節や中止等の適切な処置を行うこと. | 本剤のCYP3Aに対する阻害作用により,上記薬剤の代謝が阻害される. |
| アトルバスタチンカルシウム水和物 シンバスタチン ロバスタチン(国内未承認) | 上記薬剤の血中濃度上昇に伴う横紋筋融解症が報告されているので,異常が認められた場合には,投与量の調節や中止等の適切な処置を行うこと.腎機能障害のある患者には特に注意すること. | 本剤のCYP3Aに対する阻害作用により,上記薬剤の代謝が阻害される. |
| コルヒチン | コルヒチンの血中濃度上昇に伴う中毒症状(汎血球減少,肝機能障害,筋肉痛,腹痛,嘔吐,下痢,発熱等)が報告されているので,異常が認められた場合には,投与量の調節や中止等の適切な処置を行うこと. なお,肝臓又は腎臓に障害のある患者で,コルヒチンを投与中の患者には,本剤を併用しないこと. | 本剤のCYP3Aに対する阻害作用により,上記薬剤の代謝が阻害される. |
| *ベンゾジアゼピン系薬剤 (CYP3Aで代謝される薬剤) トリアゾラム ミダゾラム 等 非定型抗精神病薬 (CYP3Aで代謝される薬剤) クエチアピンフマル酸塩 等 ジソピラミド トルバプタン エプレレノン エレトリプタン臭化水素酸塩 カルシウム拮抗剤 (CYP3Aで代謝される薬剤) ニフェジピン ベラパミル塩酸塩 等 リオシグアト ジエノゲスト ホスホジエステラーゼ5阻害剤 シルデナフィルクエン酸塩 タダラフィル[シアリス,ザルティア]等 クマリン系抗凝血剤 ワルファリンカリウム ドセタキセル水和物 アベマシクリブ オキシコドン塩酸塩水和物 フェンタニル/フェンタニルクエン酸塩 | 上記薬剤の血中濃度上昇に伴う作用の増強等の可能性があるので,異常が認められた場合には,投与量の調節や中止等の適切な処置を行うこと. なお,トルバプタンにおいては,本剤との併用は避けることが望ましいとされており,やむを得ず併用する場合においては,トルバプタンの用量調節を特に考慮すること. | 本剤のCYP3Aに対する阻害作用により,上記薬剤の代謝が阻害される. |
| *ベネトクラクス(再発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含む)の維持投与期,急性骨髄性白血病) | ベネトクラクスの副作用が増強するおそれがあるので,ベネトクラクスを減量するとともに,患者の状態を慎重に観察すること. | 本剤のCYP3Aに対する阻害作用により,上記薬剤の代謝が阻害される. |
| 抗凝固剤 (CYP3Aで代謝され,P-糖蛋白質で排出される薬剤) アピキサバン リバーロキサバン | 上記薬剤の血中濃度上昇に伴う作用の増強等の可能性があるので,異常が認められた場合には,投与量の調節や中止等の適切な処置を行うこと. | 本剤のCYP3A及びP-糖蛋白質に対する阻害作用により,上記薬剤の代謝及び排出が阻害される. |
| 抗凝固剤 (P-糖蛋白質で排出される薬剤) ダビガトランエテキシラート エドキサバントシル酸塩水和物 | 上記薬剤の血中濃度上昇に伴う作用の増強等の可能性があるので,異常が認められた場合には,投与量の調節や中止等の適切な処置を行うこと. | 本剤のP-糖蛋白質に対する阻害作用により,上記薬剤の排出が阻害される. |
| イトラコナゾール HIVプロテアーゼ阻害剤 リトナビル等 | 本剤の未変化体の血中濃度上昇による作用の増強等の可能性がある. また,イトラコナゾールの併用においては,イトラコナゾールの血中濃度上昇に伴う作用の増強等の可能性がある. 異常が認められた場合には,投与量の調節や中止等の適切な処置を行うこと. | 本剤と上記薬剤のCYP3Aに対する阻害作用により,相互に代謝が阻害される. |
| リファブチン エトラビリン | 上記薬剤の血中濃度上昇に伴う作用の増強等の可能性がある. また,本剤の未変化体の血中濃度が低下し,活性代謝物の血中濃度が上昇し,本剤の作用が減弱する可能性がある. 異常が認められた場合には,投与量の調節や中止等の適切な処置を行うこと. | 本剤のCYP3Aに対する阻害作用により,上記薬剤の代謝が阻害される. また,上記薬剤のCYP3A4に対する誘導作用により,本剤の代謝が促進される. |
| リファンピシン エファビレンツ ネビラピン | 本剤の未変化体の血中濃度が低下し,活性代謝物の血中濃度が上昇する可能性がある.本剤の作用が減弱する可能性があるので,投与量の調節や中止等の適切な処置を行うこと. | 上記薬剤のCYP3A4に対する誘導作用により,本剤の代謝が促進される. |