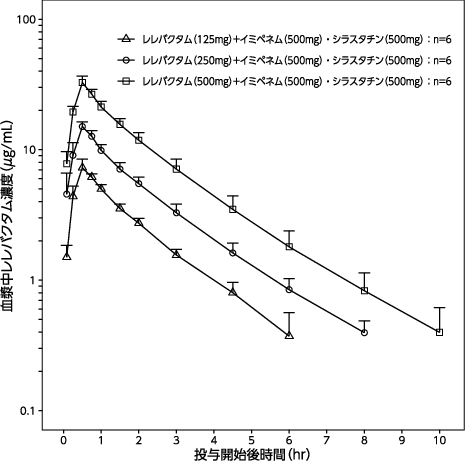
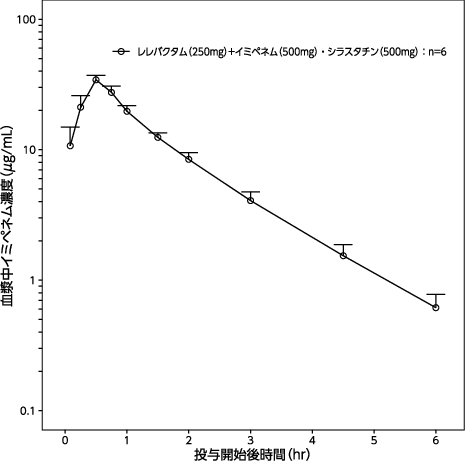
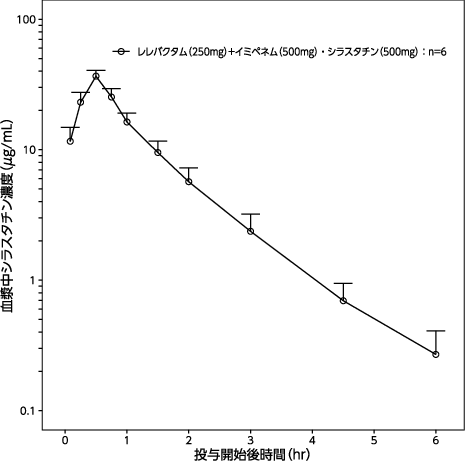
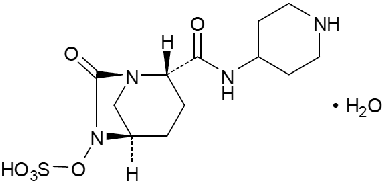
1
金井 靖, et al. Jpn Pharmacol Ther. 1997;25:2343-46.
2
鈴山 洋司, et al. Chemotherapy. 1985;33:694-711.
3
伊藤 康久, et al. Chemotherapy. 1985;33:825-33.
4
谷村 弘, et al. Chemotherapy. 1985;33:982-1000.
5
岩井 重富, et al. Chemotherapy. 1985;33:950-62.
6
鈴木 啓一郎, et al. Chemotherapy. 1985;33:942-49.
7
松田 静治, et al. Jpn. J. Antibiot. 1986;39:1626-55.
8
小島 忠士, et al. Jpn. J. Antibiot. 1986;39:1938-46.
9
松田 静治, et al. Jpn. J. Antibiot. 1988;41:1731-41.
10
Shlaes DM. Ann N Y Acad Sci. 2013;1277:105-14.
11
横田 健, et al. Chemotherapy. 1985;33:43-53.
12
中川 圭一, et al. Chemotherapy. 1985;33:357-78.
13
臼居 敏仁, et al. Chemotherapy. 1985;33:217-26.
14
今朝洞 忠考, et al. Chemotherapy. 1985;33:98-118.
15
Goldstein EJC, et al. Antimicrob Agents Chemother. 2018;62:e01992-17.
16
布施 愛索, et al. Chemotherapy. 1985;33:1-13.
17
朝日 良成, et al. Chemotherapy. 1985;33:54-73.
18
Papp-Wallace KM, et al. Antimicrob Agents Chemother. 2018;62:e00174-18.
19
Karlowsky JA, et al. J Antimicrob Chemother. 2018;73:1872-9.
20
Livermore DM, et al. J Antimicrob Chemother. 2013;68:2286-90.
21
Young K, et al. BMC Microbiol. 2019;19:150.