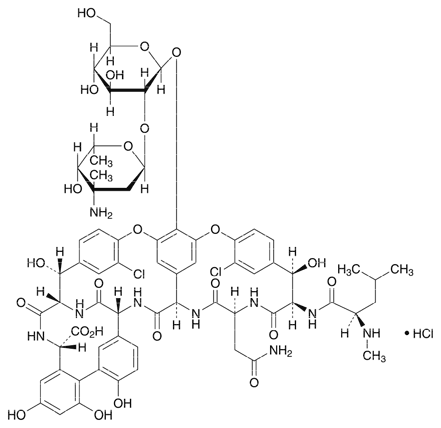
グリコペプチド系抗生物質製剤
1瓶 749円
| 形状 | 塊又は粉末(凍結乾燥品) |
|---|---|
| 色 | 白色 |
| pH | 2.5〜4.5 50mg(力価)/mL水溶液 |
| 浸透圧比 | 約1 5mg(力価)/mL(日局生理食塩液) (浸透圧比:日局生理食塩液対比) |
| 形状 | 塊又は粉末(凍結乾燥品) |
|---|---|
| 色 | 白色 |
| pH | 2.5〜4.5 50mg(力価)/mL水溶液 |
| 浸透圧比 | 約1 5mg(力価)/mL(日局生理食塩液) (浸透圧比:日局生理食塩液対比) |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| 全身麻酔薬(チオペンタール等) | 同時に投与すると、紅斑、ヒスタミン様潮紅、アナフィラキシー反応等の副作用が発現することがある。 全身麻酔の開始1時間前には本剤の点滴静注を終了する。 | 全身麻酔薬には、アナフィラキシー作用、ヒスタミン遊離作用を有するものがあり、本剤にもヒスタミン遊離作用がある。しかし、相互作用の機序は不明 |
| 腎毒性及び聴器毒性を有する薬剤(アミノグリコシド系抗生物質(アルベカシン、トブラマイシン等)、白金含有抗悪性腫瘍剤(シスプラチン、ネダプラチン等) | 腎障害、聴覚障害が発現、悪化するおそれがあるので、併用は避けること。やむを得ず併用する場合は、慎重に投与する。 | 機序:両剤共に腎毒性、聴器毒性を有するが、相互作用の機序は不明 危険因子:腎障害のある患者、高齢者、長期投与の患者等 |
| 腎毒性を有する薬剤(アムホテリシンB、シクロスポリン等) | 腎障害が発現、悪化するおそれがあるので、併用は避けること。やむを得ず併用する場合は、慎重に投与する。 | 機序:両剤共に腎毒性を有するが、相互作用の機序は不明 危険因子:腎障害のある患者、高齢者、長期投与の患者等 |
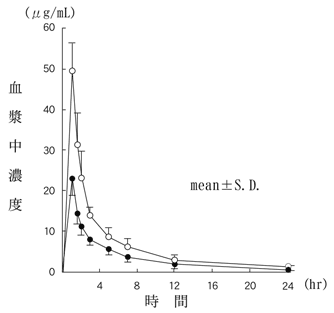
| 記号 | 投与量〔g(力価)〕 | n | Cmax (μg/mL) | AUC0-∞ (μg・hr/mL) | T1/2 (hr) |
| ● | 0.5 | 6 | 23.0 | 85 | 4.29 |
| ○ | 1.0 | 6 | 49.5 | 166 | 5.23 |
| No. | 年齢 | Cmax (μg/mL) | AUC0-∞ (μg・hr/mL) | T1/2α (hr) | T1/2β (hr) | CL (mL/min/kg) | Vc (L/kg) |
| 1 | 1歳 | 29.0 | 78 | 0.29 | 2.52 | 2.13 | 0.21 |
| 2 | 1歳10ヵ月 | 27.0 | 75 | 0.31 | 3.21 | 2.23 | 0.22 |
| 3 | 2歳1ヵ月 | 20.7 | 59 | 0.51 | 2.08 | 2.81 | 0.44 |
| 4 | 2歳9ヵ月 | 19.8 | 67 | 0.65 | 5.70 | 2.49 | 0.43 |
| 5 | 11歳 | 49.1 | 113 | 0.29 | 4.17 | 1.47 | 0.16 |
| mean | − | 29.1 | 78 | 0.41 | 3.54 | 2.23 | 0.29 |
| No | 修正在胎 (週) | 日齢 (日) | 体重 (g) | SCr (mg/dL) | 投与量注5) (mg/kg/日) | Cmax注6) (μg/mL) | T1/2 (hr) | CL (mL/kg/min) | Vc (L/kg) |
| 1 | 25 | 19 | 442 | 0.6 | 15×1 | 22.8 | 11.01 | 0.867 | 0.769 |
| 2 | 26 | 10 | 472 | 1.9 | 15×1 | 35.1 | 29.42 | 0.281 | 0.627 |
| 3 | 30 | 31 | 708 | 0.7 | 25×1 | 39.3 | 19.70 | 0.549 | 0.908 |
| 4 | 28 | 20 | 735 | 1.0 | 15×1 | 28.3 | 20.78 | 0.819 | 0.297 |
| 5 | 30 | 40 | 790 | 0.6 | 25×1 | 58.8 | 8.22 | 0.657 | 0.257 |
| 6 | 29 | 19 | 1064 | 0.8 | 25×1 | 44.7 | 8.51 | 0.915 | 0.477 |
| 7 | 32 | 17 | 1188 | 0.7 | 25×1 | 50.8 | 9.06 | 1.028 | 0.417 |
| 8 | 33 | 11 | 1512 | 0.7 | 17.5×2 | 46.5 | 8.19 | 0.753 | 0.359 |
| 9 | 38 | 19 | 1844 | 0.4 | 17.5×2 | 25.2 | 10.32 | 0.982 | 0.875 |
| 10 | 43 | 10 | 2060 | 0.5 | 20×2 | 62.2 | 7.99 | 0.745 | 0.212 |
| No. | 1 | 2 | 3 | 4 | 5 | 6 |
| 年齢(歳) | 84 | 87 | 73 | 78 | 74 | 74 |
| Ccr(mL/min) | 19.3 | 21.0 | 34.4 | 51.3 | 62.6 | 62.7 |
| 患者群 | n | 年齢(歳) | 体重(kg) | Ccr (mL/min) | Cmax (μg/mL) | AUC0-∞ (μg・hr/mL) | T1/2 (hr) |
| 高齢者 | 6 | 78.3 | 34.8 | 41.9 | 22.6 | 186 | 12.99 |
| 健康成人 | 6 | 22.0 | 62.7 | 115.0 | 38.0 | 110 | 2.98 |
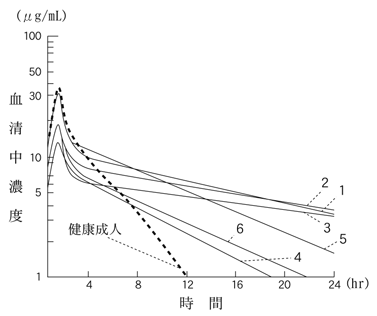
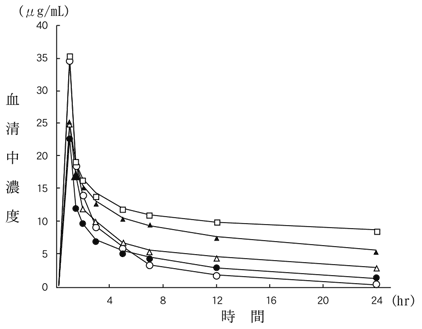
| 記号 | 患者群 | Ccr(mL/min) | n | Cmax (μg/mL) | AUC0-∞ (μg・hr/mL) | T1/2α (hr) | T1/2β (hr) |
| ○ | 健康成人 | 70≦Ccr | 4 | 34.53 | 90.4 | 0.32 | 3.08 |
| ● | 腎障害A群 | 50≦Ccr<70 | 4 | 22.60 | 95.4 | 0.43 | 7.41 |
| △ | 腎障害B群 | 30≦Ccr<50 | 5 | 22.85 | 163.2 | 0.70 | 10.73 |
| ▲ | 腎障害C群 | 15≦Ccr<30 | 4 | 24.99 | 374.8 | 0.49 | 20.22 |
| □ | 腎障害D群 | Ccr<15 | 6 | 35.13 | 682.8 | 0.38 | 35.49 |