作成又は改訂年月
**
2022年12月改訂
(第14版、承継に伴う改訂)
*
2017年10月改訂
日本標準商品分類番号
日本標準商品分類番号等
薬効分類名
ロイコトリエン受容体拮抗剤
気管支喘息・アレルギー性鼻炎治療剤
承認等
販売名
**プランルカスト錠112.5mg「NIG」
販売名コード
承認・許可番号
22100AMX00025
Pranlukast Tab.
薬価収載
販売開始
使用期限等
組成
有効成分
日局 プランルカスト水和物
含量
1錠中 112.5mg
添加物
乳糖水和物、デキストリン、低置換度ヒドロキシプロピルセルロース、結晶セルロース、タルク、ステアリン酸マグネシウム
性状
白色〜淡黄色の素錠
外形(表面)
外形(裏面)
外形(側面)
直径
7.5mm
厚み
2.7mm
質量
約150mg
識別コード(本体)

404
識別コード(PTP)
TYK404
販売名
**プランルカスト錠225mg「NIG」
販売名コード
承認・許可番号
22300AMX00238
Pranlukast Tab.
薬価収載
販売開始
使用期限等
組成
有効成分
日局 プランルカスト水和物
含量
1錠中 225mg
添加物
乳糖水和物、デキストリン、低置換度ヒドロキシプロピルセルロース、結晶セルロース、タルク、ステアリン酸マグネシウム
性状
白色〜淡黄色の割線入り素錠
外形(表面)
外形(裏面)
外形(側面)
直径
9.5mm
厚み
3.4mm
質量
約300mg
識別コード(本体)

407
識別コード(PTP)
TYK407
一般的名称
禁忌
効能・効果
用法・用量
通常、成人にはプランルカスト水和物として1日量450mg(112.5mg錠:4錠、225mg錠:2錠)を朝食後及び夕食後の2回に分けて経口投与する。
なお、年齢、症状により適宜増減する。
使用上の注意
重要な基本的注意
本剤は気管支拡張剤、ステロイド剤等と異なり、すでに起こっている喘息発作を緩解する薬剤ではないので、このことは患者に十分説明しておく必要がある。
気管支喘息患者に本剤を投与中、大発作をみた場合は、気管支拡張剤あるいはステロイド剤を投与する必要がある。
長期ステロイド療法を受けている患者で、本剤投与によりステロイドの減量をはかる場合は十分な管理下で徐々に行うこと。
本剤投与によりステロイド維持量を減量し得た患者で、本剤の投与を中止する場合は、原疾患再発のおそれがあるので注意すること。
本剤を含めロイコトリエン拮抗剤使用時にChurg-Strauss症候群様の血管炎を生じたとの報告がある。これらの症状は、おおむね経口ステロイド剤の減量・中止時に生じている。本剤使用時は、特に好酸球数の推移及びしびれ、四肢脱力、発熱、関節痛、肺の浸潤影等の血管炎症状に注意すること。
他のロイコトリエン拮抗剤を投与した患者で、因果関係は明らかではないがうつ病、自殺念慮、自殺及び攻撃的行動を含む精神症状が報告されているので、本剤の投与にあたっては患者の状態を十分に観察すること。
本剤投与により効果が認められない場合には、漫然と長期にわたり投与しないように注意すること。
相互作用
併用注意
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|
| 主にCYP3A4によって代謝される薬剤 | 本剤及びこれらの薬剤の血中濃度が上昇する可能性がある。 | 本剤はin vitro試験でCYP3A4により代謝され、これらの薬剤の代謝を競合的に阻害するとの報告がある。 |
|---|
CYP3A4を阻害する薬剤
イトラコナゾール
エリスロマイシン 等 | 本剤の血中濃度が上昇する可能性がある。 | in vitro、in vivo試験でこれらの薬剤により本剤の代謝が阻害されるとの報告がある。 |
|---|
副作用
本剤は使用成績調査等の副作用発現頻度が明確となる調査を実施していない。
重大な副作用
ショック、アナフィラキシー:
(頻度不明)
ショック、アナフィラキシーがあらわれることがあるので、観察を十分に行い、血圧低下、意識障害、呼吸困難、発疹等があらわれた場合には投与を中止し、適切な処置を行うこと。
白血球減少:
(頻度不明)
白血球減少(初期症状:発熱、咽頭痛、全身けん怠感等)があらわれることがあるので、このような症状があらわれた場合には投与を中止すること。
血小板減少:
(頻度不明)
血小板減少(初期症状:紫斑、鼻出血、歯肉出血等の出血傾向)があらわれることがあるので、このような症状があらわれた場合には投与を中止すること。
肝機能障害:
(頻度不明)
黄疸、AST(GOT)・ALT(GPT)の著しい上昇等を伴う肝機能障害があらわれることがあるので、観察を十分に行い、このような場合には投与を中止し適切な処置を行うこと。
間質性肺炎、好酸球性肺炎:
(頻度不明)
発熱、咳嗽、呼吸困難、胸部X線異常、好酸球増加等を伴う間質性肺炎、好酸球性肺炎があらわれることがあるので、このような症状があらわれた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
横紋筋融解症:
(頻度不明)
*横紋筋融解症があらわれることがあるので、筋肉痛、脱力感、CK(CPK)上昇、血中ミオグロビン上昇等の症状があらわれた場合には投与を中止し、適切な処置を行うこと。また、横紋筋融解症による急性腎障害の発症に注意すること。
その他の副作用
過敏症注)
頻度不明
発疹、そう痒、蕁麻疹、多形滲出性紅斑等
精神神経系
頻度不明
頭痛、眠気、めまい、不眠、しびれ、味覚異常、ふるえ、けいれん、興奮、不安
消化器
頻度不明
嘔気、腹痛、胃部不快感、下痢、嘔吐、胸やけ、食欲不振、便秘、腹部膨満感、口内炎、舌炎、舌しびれ
循環器
頻度不明
不整脈(頻脈・心房細動・期外収縮等)、動悸、潮紅
肝臓
頻度不明
ビリルビン上昇、AST(GOT)・ALT(GPT)の上昇、アルカリホスファターゼ上昇等
筋骨格系
頻度不明
関節痛、筋肉痛、四肢痛、こわばり、CK(CPK)上昇
泌尿器
頻度不明
蛋白尿、尿潜血、頻尿、尿量減少、排尿障害、BUN上昇
その他
頻度不明
胸部絞扼感、発熱、浮腫、けん怠感、トリグリセリド上昇、出血、好酸球増多、咽喉頭異常感、口渇、耳鳴、尿沈渣陽性、脱毛、生理不順、乳房腫脹・硬結、乳房痛、女性化乳房
注)発現した場合には、投与を中止するなど適切な処置を行うこと。
高齢者への投与
一般に高齢者では生理機能が低下しているので減量する(例えば、112.5mg錠:1回1錠を1日2回)など注意すること。
妊婦、産婦、授乳婦等への投与
妊婦又は妊娠している可能性のある婦人には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。〔妊娠中の投与に関する安全性は確立していない。〕
小児等への投与
低出生体重児、新生児、乳児、幼児又は小児に対する安全性は確立していない(使用経験が少ない)。
適用上の注意
薬剤交付時
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。(PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することが報告されている。)
薬物動態
生物学的同等性試験1)
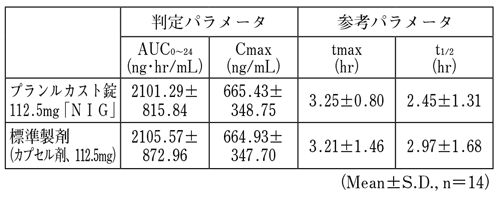
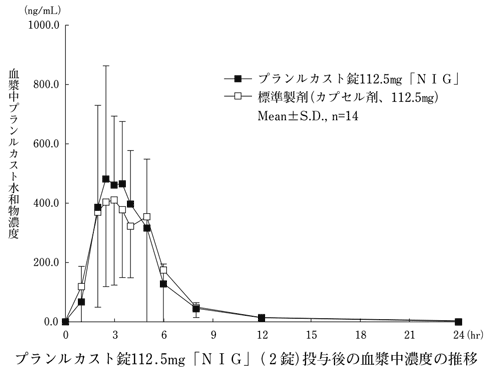
○プランルカスト錠112.5mg「NIG」
プランルカスト錠112.5mg「NIG」と標準製剤をクロスオーバー法により、それぞれ2錠又は2カプセル(プランルカスト水和物として225mg)を健康成人男子に空腹時単回経口投与して血漿中プランルカスト水和物濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された。
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
○プランルカスト錠225mg「NIG」
プランルカスト錠225mg「NIG」は、「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン(平成18年11月24日付薬食審査発第1124004号)」に基づき、プランルカスト錠112.5mg「NIG」を標準製剤としたとき、溶出挙動が等しく、生物学的に同等とみなされた。
薬効薬理
プランルカストは、システイニルロイコトリエン(cys-LTs;LTC4、LTD4、LTE4)の受容体拮抗薬で、cys-LTsによる気管支平滑筋の収縮を抑制することにより喘息症状の改善に寄与しているものと考えられる。また、プランルカストはcys-LTsによる毛細血管透過性、粘液分泌亢進、気道への好酸球及び好塩基球の浸潤を抑制するといわれている2)。
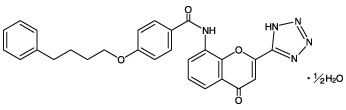
有効成分に関する理化学的知見
一般名
プランルカスト水和物、Pranlukast Hydrate(JAN)
化学名
N-[4-Oxo-2-(1H-tetrazol-5-yl)-4H-chromen-8-yl]-4-(4-phenylbutyloxy)benzamide hemihydrate
分子式
C27H23N5O4・1/2H2O
分子量
490.51
構造式
性状
白色〜淡黄色の結晶性の粉末である。
エタノール(99.5)に極めて溶けにくく、水にほとんど溶けない。
融点
約233℃(分解)
取扱い上の注意
安定性試験3)
最終包装製品を用いた加速試験(40℃、相対湿度75%、6ヵ月)の結果、プランルカスト錠112.5mg「NIG」及びプランルカスト錠225mg「NIG」は通常の市場流通下において3年間安定であることが推測された。
包装
**プランルカスト錠112.5mg「NIG」:140錠(PTP14錠×10)、700錠(PTP14錠×50)
プランルカスト錠225mg「NIG」:140錠(PTP14錠×10)
主要文献及び文献請求先
主要文献
1
日医工岐阜工場(株) :社内資料(生物学的同等性試験)
2
グッドマン・ギルマン薬理書−薬物治療の基礎と臨床−,第10版,廣川書店 2003;945-946
3
日医工岐阜工場(株) :社内資料(安定性試験)
文献請求先・製品情報お問い合わせ先
**主要文献欄に記載の文献・社内資料は下記にご請求下さい。
日医工株式会社 お客様サポートセンター
〒930-8583 富山市総曲輪1丁目6番21
TEL (0120) 517-215
FAX (076) 442-8948
製造販売業者等の氏名又は名称及び住所
販売
武田薬品工業株式会社
大阪市中央区道修町四丁目1番1号
**発売元
日医工株式会社
富山市総曲輪1丁目6番21
**製造販売元
日医工岐阜工場株式会社
富山市総曲輪1丁目6番21



 404
404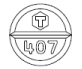

 407
407