1
久保敦司,ほか:核医学. 1992;29:1019-1027
2
米倉義晴,ほか:核医学. 1993;30:397-410
3
Orlandi C,et al.:Stroke. 1990;21:1059-1063
4
Walovitch RC,et al.:J Nucl Med. 1989;30:1892-1901

放射性医薬品/局所脳血流診断薬
1回分 18730円
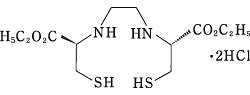
有効成分 | バイアルA 1バイアル中 N,N'-(1,2-エチレン)ビス-L-システインジエチルエステル二塩酸塩 0.90mg |
|---|---|
添加剤 | バイアルA 1バイアル中 塩化スズ(Ⅱ)二水和物 0.072mg、エデト酸ナトリウム水和物 0.36mg、D-マンニトール 24.0mg、塩酸 適量 |
有効成分 | バイアルB - |
|---|---|
添加剤 | バイアルB 1バイアル中 1mL リン酸二水素ナトリウム一水和物 0.460mg、リン酸水素二ナトリウム七水和物 4.105mg |
| pH | 調製後注射液:6.5~7.5 |
|---|---|
| 浸透圧比 | 調製後注射液:約1(生理食塩液に対する比) |
| 外観 | バイアルA:白色結晶性粉末 バイアルB:無色澄明の液 調製後注射液(〔N,N'-エチレンジ-L-システイネート(3-)〕オキソテクネチウム(99mTc),ジエチルエステル):無色澄明の液 |
頻度不明 | |
|---|---|
過敏症 | 紅斑、蕁麻疹、そう痒感、発疹 |
消化器 | 嘔気、嘔吐 |
その他 | しびれ、発熱 |
臓器 | 吸収線量(mGy/MBq) | 臓器 | 吸収線量(mGy/MBq) | ||
2.5時間後排尿 | 4.5時間後排尿 | 2.5時間後排尿 | 4.5時間後排尿 | ||
脳 | 0.0051 | 0.0051 | 大腸上部 | 0.0068 | 0.0073 |
肺 | 0.0015 | 0.0015 | 大腸下部 | 0.011 | 0.012 |
心臓 | 0.0043 | 0.0043 | 膀胱壁 | 0.073 | 0.11 |
肝臓 | 0.0016 | 0.0016 | 卵巣 | 0.0049 | 0.0062 |
脾臓 | 0.0013 | 0.0013 | 精巣 | 0.0051 | 0.0062 |
腎臓 | 0.0032 | 0.0035 | 全身 | 0.0010 | 0.0010 |
小腸 | 0.0051 | 0.0057 | |||
経過時間 (時間) | 残存放射能 (%) | 経過時間 (時間) | 残存放射能 (%) | 経過時間 (時間) | 残存放射能 (%) |
-3 -2 -1 0 1 2 3 4 5 6 7 8 | 141.3 125.9 112.2 100 89.1 79.4 70.8 63.1 56.2 50.1 44.6 39.8 | 9 10 11 12 13 14 15 16 17 18 19 20 | 35.4 31.6 28.2 25.1 22.4 19.9 17.8 15.8 14.1 12.6 11.2 10.0 | 21 22 23 24 25 26 27 28 29 30 | 8.9 7.9 7.1 6.3 5.6 5.0 4.5 4.0 3.5 3.2 |