1
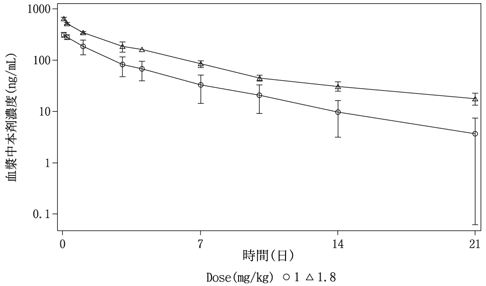
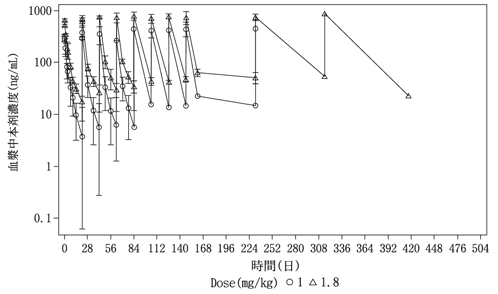
国内第Ⅰ相試験(JO29138試験)(2021年3月23日承認、CTD2.7.2.2.3.1)
2
MMAEのin vitro血漿蛋白質結合及び血球移行(2021年3月23日承認、CTD2.6.4.4.2)
3
MMAEの代謝関与酵素の同定(2021年3月23日承認、CTD2.6.4.5.2.1)
4
ラットにおけるポラツズマブ ベドチン投与後のマスバランス(2021年3月23日承認、CTD2.6.4.6.1)
5
薬物相互作用(2021年3月23日承認、CTD2.7.2.3.5.1)
6
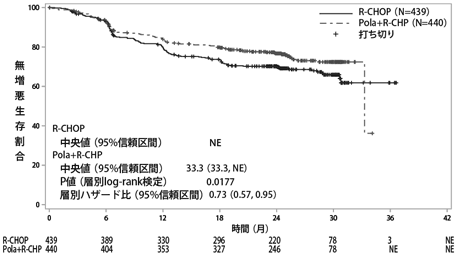
社内資料:国際共同第Ⅲ相試験(GO39942試験[POLARIX試験])
7
海外第Ⅰb/Ⅱ相試験(GO29365試験)(2021年3月23日承認、CTD2.7.3.1-3、2.7.4.2.1.1)
8
Sehn LH, et al. J Clin Oncol 2020;38:155-65.
9
国内第Ⅱ相試験(JO40762試験[P-DRIVE試験])(2021年3月23日承認、CTD2.7.3.1-3、2.7.4.2.1.1)
10
Li D, et al. Br J Pharmcol 2019;176:3805-18.
11
Pfeifer M, et al. Leukemia 2015;29:1578-86.
12
Polson AG, et al. Blood 2007;110:616-23.
13
Polson AG, et al. Cancer Res 2009;69:2358-64.
14
Sutherland MSK, et al. J Biol Chem 2006;281:10540-7.
15
Bai R, et al. J Biol Chem 1990;265:17141-9.
16
Doronina SO, et al. Nat Biotechnol 2003;21:778-84.
17
Francisco JA, et al. Blood 2003;102:1458-65.
18
WSU-DLCL2移植モデルにおける抗腫瘍効果(2021年3月23日承認、CTD2.6.2.2.2.2)
19
WSU-DLCL2移植モデルにおけるポラツズマブ ベドチンとリツキシマブ+化学療法薬との併用効果(2021年3月23日承認、CTD2.6.2.2.2.5)







注4)生理食塩液に対する比