1
社内資料:拡充型出生前及び出生後の発生に関する試験(2015年7月3日承認,CTD 2.4.4.5)
2
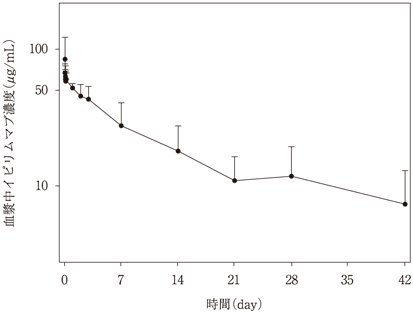
社内資料:海外第1相臨床試験(MDX010-15)(2015年7月3日承認,CTD 2.7.6.2)
3
社内資料:国内第2相臨床試験(CA184396)(2015年7月3日承認,CTD 2.7.6.11)
4
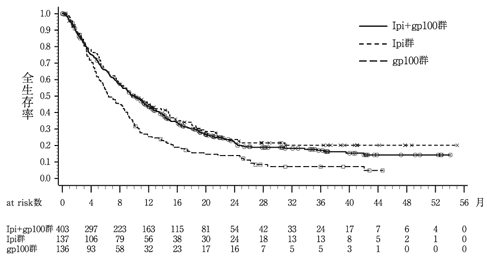
Hodi FS, et al.:N.Engl.J.Med.,2010;363(8):711-723
5
社内資料:国内第2相臨床試験(ONO-4538-17)
6
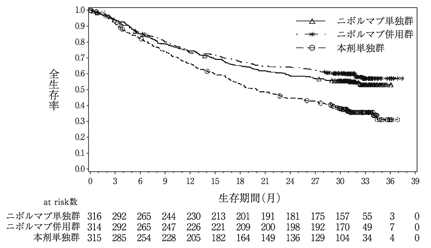
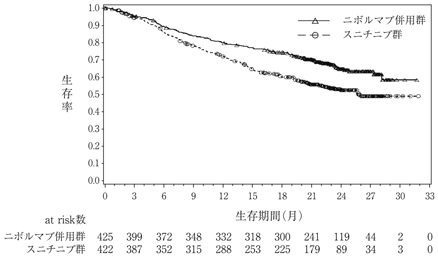
社内資料:海外第3相臨床試験(CA209067)
7
Motzer R.J. et al.:N.Engl.J.Med., 2018;378:1277-1290(CA209214)
8
Overman M.J. et al.:J.Clin.Oncol.,2018;36:773-779(CA209142)
9
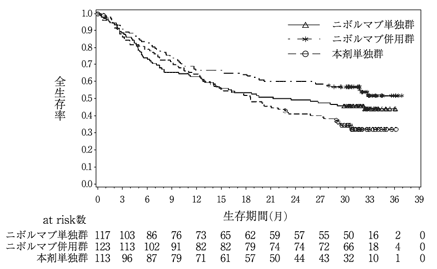
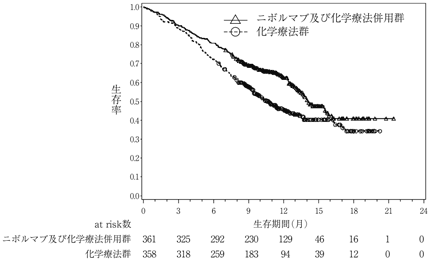
社内資料:国際共同第3相臨床試験(CA209227)
10
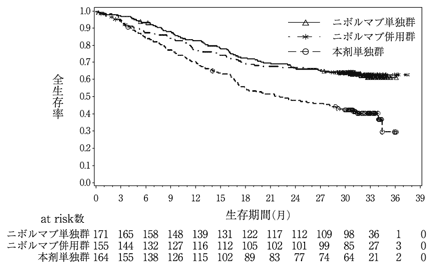
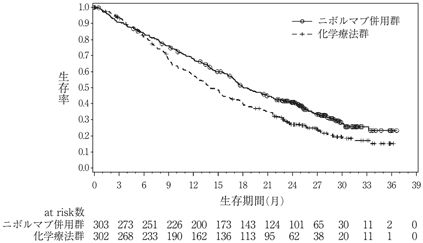
社内資料:国際共同第3相臨床試験(CA2099LA)
11
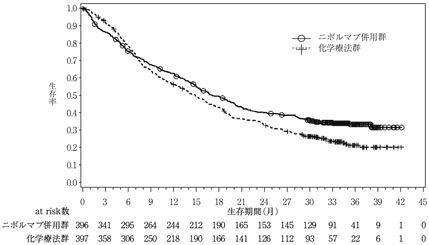
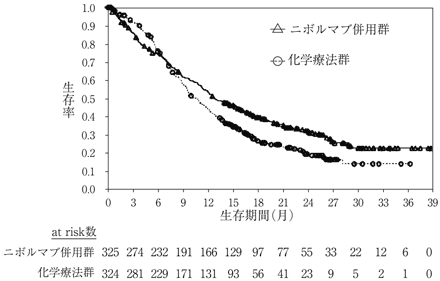
社内資料:国際共同第3相臨床試験(CA209743)(2021年5月27日承認,CTD 2.7.6.5)
12
社内資料:国際共同第3相臨床試験(CA209648)