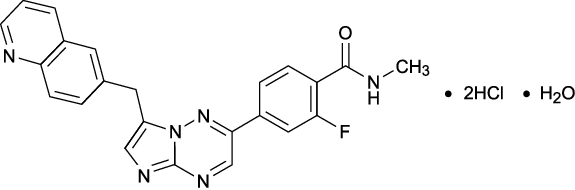
1
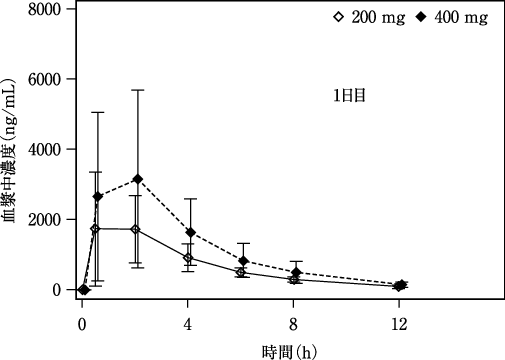
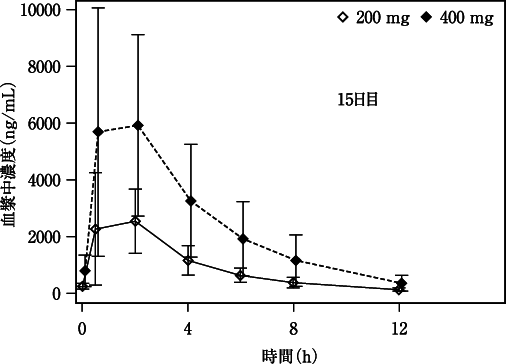
社内資料:国内第Ⅰ相試験(X1101試験)(2020年6月29日承認、CTD2.7.2-2.3.1)[20200169]
2
社内資料:国際共同第Ⅱ相試験(A2201試験)(2020年6月29日承認、CTD2.7.6-4.2.1)[20200170]
3
社内資料:健康被験者での食事の影響に関する検討(X2107試験)(2020年6月29日承認、CTD2.7.1-2.1.2)[20200175]
4
社内資料:血球分布と血漿タンパク結合率(2020年6月29日承認、CTD2.7.2-2.1.1)[20200178]
5
社内資料:放射性標識体を用いたADME試験(2020年6月29日承認、CTD2.7.2-2.2.1)[20200179]
6
社内資料:肝機能障害の影響(2020年6月29日承認、CTD2.7.2-2.3.8)[20200182]
7
社内資料:リファンピシン及びイトラコナゾールとの薬物相互作用(2020年6月29日承認、CTD2.7.2-2.2.3)[20200184]
8
社内資料:CYP3Aを介した薬物相互作用に関するシミュレーション(2020年6月29日承認、CTD2.7.2-3.3.1)[20200185]
9
社内資料:ミダゾラム及びカフェインとの薬物相互作用(2020年6月29日承認、CTD2.7.2-2.3.6)[20200186]
10
社内資料:ジゴキシン及びロスバスタチンとの薬物相互作用(2020年6月29日承認、CTD2.7.2-2.3.7)[20200187]
11
社内資料:ラべプラゾールとの薬物相互作用(2020年6月29日承認、CTD2.7.2-2.2.2)[20200188]
12
社内資料:代謝酵素及びトランスポーターに関する検討(2020年6月29日承認、CTD2.7.2-2.1)[20200181]
13
Baltschukat, S. et al.:Clin. Cancer Res. 2019;25(10):3164-3175[20200191]