1
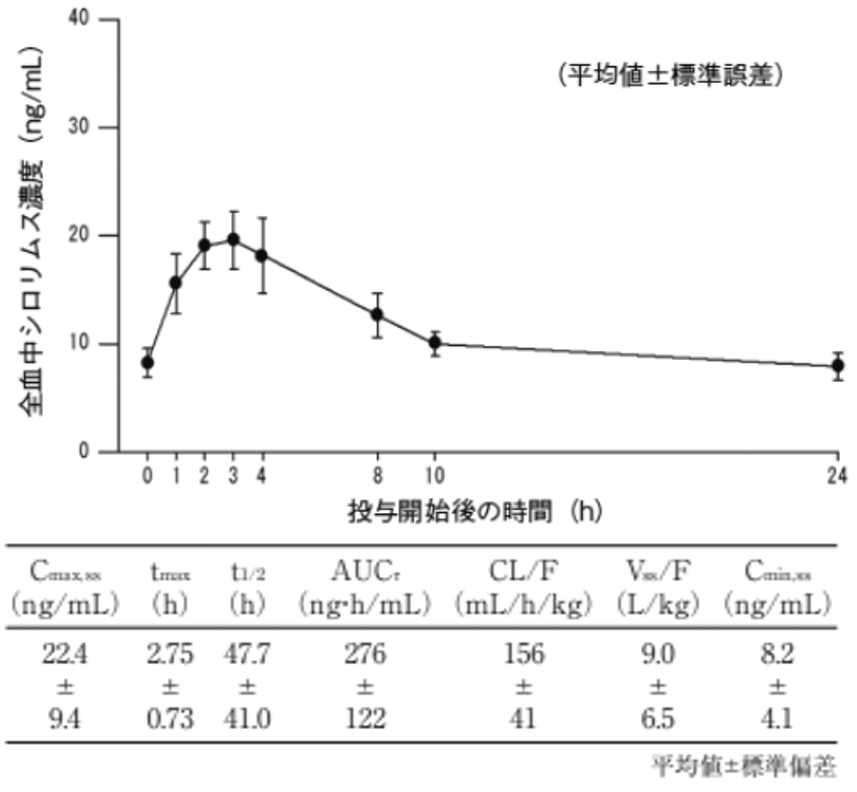
社内資料:NPC-12T-1試験 治験総括報告書(2024年1月18日承認、申請資料概要2.7.6.1)
2
社内資料:母集団薬物動態解析(2024年1月18日承認、申請資料概要2.7.2.3)
3
社内資料:ラット胚・胎児発生に関する試験(2014年7月4日承認、申請資料概要2.6.6.6)
4
El-Hashemite N, et al.: Cancer Res. 2003; 63(17): 5173-7
5
社内資料:マウスがん原性試験報告書(2014年7月4日承認、申請資料概要2.6.6.5)
6
社内資料:ラットの52週経口投与毒性試験報告書(2014年7月4日承認、申請資料概要2.6.6.9)
7
Sanchez CP, et al.: BMC Pediatr. 2009; 9: 3
8
社内資料:MLSTS試験 研究総括報告書(2014年7月4日承認、申請資料概要2.7.6.1)
9
社内資料:NPC-12T-LM試験 治験総括報告書(2021年9月27日承認、申請資料概要2.7.6.1)
10
社内資料:NPC-12T-CVA試験 治験総括報告書(2024年1月18日承認、申請資料概要2.7.6.2)
11
社内資料:高脂肪食の影響(2014年7月4日承認、申請資料概要2.7.2.2)
12
社内資料:食事の影響(2024年1月18日承認、申請資料概要2.7.1.3)
13
社内資料:血球中の分布(2014年7月4日承認、申請資料概要2.7.2.2)
14
Zimmerman JJ, et al.: J Clin Pharmacol. 2008; 48: 285-92
15
Crowe A and Lemaire M.: Pharm Res. 1998; 15(11): 1666-72
16
社内資料:代謝(2014年7月4日承認、申請資料概要2.5.3.1)
17
社内資料:排泄(2014年7月4日承認、申請資料概要2.7.6.2)
18
Zimmerman JJ, et al.: J Clin Pharmacol. 2005; 45: 1368-72
19
社内資料:ジルチアゼムとの薬物相互作用(2014年7月4日承認、申請資料概要2.7.6.2)
20
社内資料:ベラパミルとの薬物相互作用(2014年7月4日承認、申請資料概要2.7.6.2)
21
社内資料:エリスロマイシンとの薬物相互作用(2014年7月4日承認、申請資料概要2.7.6.2)
22
社内資料:ケトコナゾールとの薬物相互作用(2014年7月4日承認、申請資料概要2.7.6.2)
23
社内資料:リファンピシンとの薬物相互作用(2014年7月4日承認、申請資料概要2.7.6.2)
24
社内資料:シクロスポリンとの薬物相互作用(2014年7月4日承認、申請資料概要2.7.6.2)
25
McCormack FX, et al.: N Engl J Med. 2011; 364(17): 1595-606
26
Goncharova EA, et al.: J Biol Chem. 2002; 277(34): 30958-67
27
Goncharova EA, et al.: Mol Cell Biol. 2011; 31(12): 2484-98
28
Goncharova EA, et al.: Mol Pharmacol. 2008; 73(3): 778-88
29
Huber S, et al.: Kidney International 2007(71): 771-7
30
Boscolo E, et al.: Angiogenesis. 2015 Apr; 18(2): 151–62
31
Goncharova EA, et al.: Sci Transl Med. 2012; 4(154): 154ra134
32
Zheng N, et al.: Current Therapeutic Research (76)2014; 99–103
33
Boscolo E, et al.: J Clin Invest. 2015; 125(9): 3491-504
34
Kobayashi S, et al.: Cancer Sci 2007; 98(5): 726-33