1
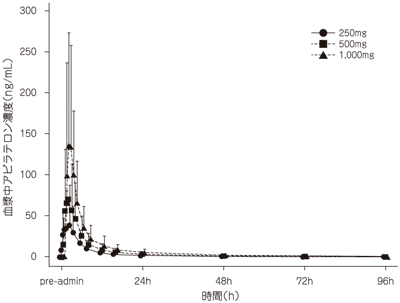
社内資料:健康成人におけるアビラテロンの薬物動態の検討(2014年7月4日承認、CTD2.7.2.2.2.1)
2
社内資料:患者におけるアビラテロンの薬物動態の検討(2014年7月4日承認、CTD2.7.2.3.1.1)
3
社内資料:フィルムコーティング錠と素錠の生物学的同等性試験
4
社内資料:アビラテロンの薬物動態に対する食事の影響の検討(2014年7月4日承認、CTD2.7.2.3.1.1)
5
社内資料:アビラテロンの薬物動態に対する食事のタイミングの影響の検討(2014年7月4日承認、CTD2.7.2.3.1.1)
6
社内資料:アビラテロンの血漿蛋白結合の検討(2014年7月4日承認、CTD2.7.2.3.1.2)
7
社内資料:アビラテロンの母集団薬物動態解析による検討(2014年7月4日承認、CTD2.7.2.3.5.1)
8
社内資料:アビラテロンのマスバランスの検討(2014年7月4日承認、CTD2.7.2.3.1.3)
9
社内資料:軽度及び中等度肝機能障害患者におけるアビラテロンの薬物動態の検討(2014年7月4日承認、CTD2.7.2.2.2.3)
10
社内資料:重度肝機能障害患者におけるアビラテロンの薬物動態の検討(2014年7月4日承認、CTD2.7.2.2.2.3)
11
社内資料:腎機能障害患者におけるアビラテロンの薬物動態の検討(2014年7月4日承認、CTD2.7.2.2.2.3)
12
社内資料:テオフィリン又はデキストロメトルファンとアビラテロンの相互作用の検討(2014年7月4日承認、CTD2.7.2.2.2.4)
13
社内資料:リファンピシンとアビラテロンの相互作用の検討(2014年7月4日承認、CTD2.7.2.2.2.4)
14
社内資料:ケトコナゾールとアビラテロンの相互作用の検討(2014年7月4日承認、CTD2.7.2.2.2.4)
15
社内資料:ピオグリタゾンとアビラテロンの相互作用の検討
16
社内資料:アビラテロンの排出トランスポーターを介した相互作用の検討(2014年7月4日承認、CTD2.6.4.7.1)
17
社内資料:アビラテロンのOATP1B1阻害に関する検討
18
Ryan CJ, et al.:N Engl J Med. 2013;368:138-148
19
de Bono JS, et al.:N Engl J Med. 2011;364:1995-2005
20
社内資料:化学療法未治療患者を対象とした国内第Ⅱ相臨床試験成績(2014年7月4日承認、CTD2.7.3.2.1.2)
21
社内資料:ドセタキセルを含む化学療法既治療患者を対象とした国内第Ⅱ相臨床試験成績(2014年7月4日承認、CTD2.7.3.2.2.1)
22
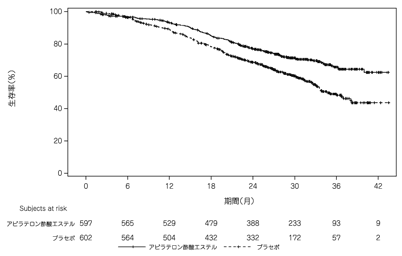
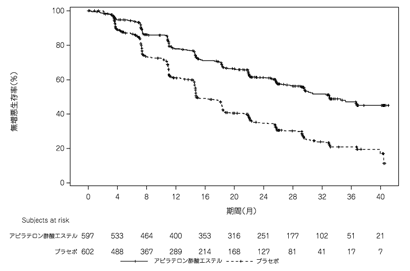
社内資料:内分泌療法未治療のハイリスクの予後因子を有する前立腺癌患者を対象とした国際共同第Ⅲ相試験成績
23
Potter GA, et al.:J Med Chem. 1995;38:2463-2471
24
Haidar S, et al.:J Steroid Biochem Mol Biol. 2003;84:555-562
25
社内資料:細胞内ステロイド合成阻害作用(2014年7月4日承認、CTD2.6.2.1.1.1)
26
Barrie SE, et al.:J Steroid Biochem Mol Biol. 1994;50:267-273
27
Duc I, et al.:J Steroid Biochem Mol Biol. 2003;84:537-542
28
Mostaghel EA, et al.:Clin Cancer Res. 2011;17:5913-5925