1
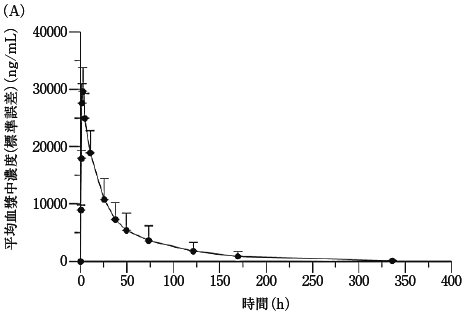
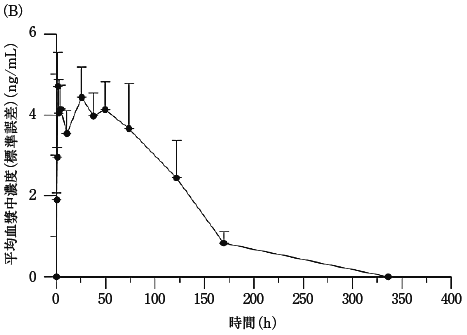
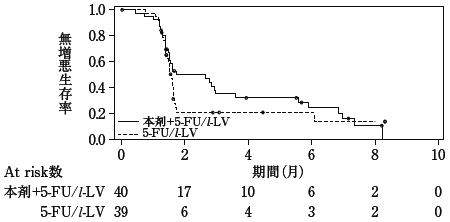
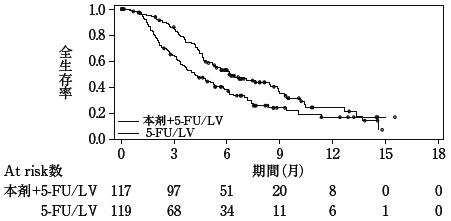
社内資料:国内第II相臨床試験(331501試験)
2
社内資料:海外第I相臨床試験(PEP0201試験)
3
社内資料:Human plasma protein binding to nanoliposomal irinotecan
4
Mathijssen RHJ, et al. Clin cancer Res. 2001;7(8):2182-94
5
Slatter JG, et al. Drug Metab. Dispos. 2000;28(4):423–33
6
Kawato Y, et al. Cancer Res. 1991;51(16):4187-91
7
社内資料:Antitumor activity against ectopic patient-derived pancreatic cancer xenograft models in CB.17 SCID mice
8
社内資料:Antitumor activity against ectopic cell line-derived pancreatic cancer xenograft models in NOD-SCID mice
9
Kalra AV, et al. Cancer Res. 2014;74(23):7003-13