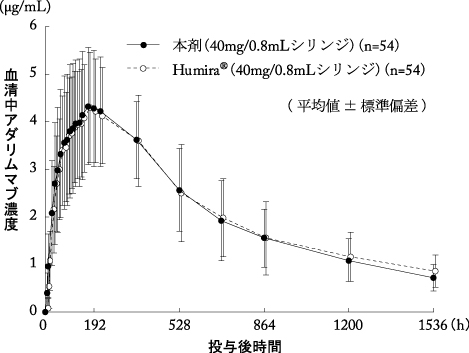
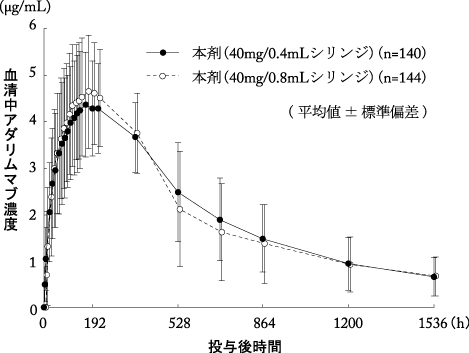
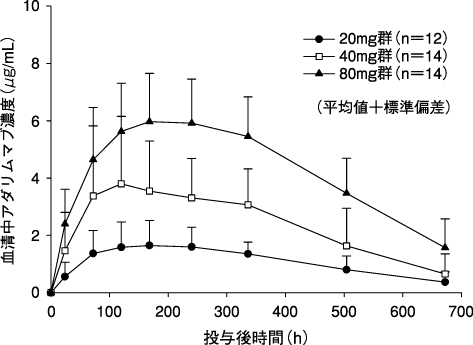
1
Breedveld, F. C. et al.:Arthritis Rheum. 2006;54:26-37〔AYM210027〕
2
Keystone, E. C. et al.:Arthritis Rheum. 2004;50:1400-1411〔AYM210028〕
3
van der Heijde, D. et al.:Arthritis Rheum. 2006;54:2136-2146〔AYM210029〕
4
Colombel, J. F. et al.:Gastroenterology. 2007;132:52-65〔AYM210030〕
5
Weinblatt, M. E. et al.:Arthritis Rheum. 2003;48:35-45〔AYM210031〕
6
Furst, D. E. et al.:J. Rheumatol. 2003;30:2563-2571〔AYM210032〕
7
Gladman, D. D. et al.:Ann. Rheum. Dis. 2007;66:163-168〔AYM210033〕
8
Gladman, D. D. et al.:Arthritis Rheum. 2007;56:476-488〔AYM210034〕
9
Hanauer, S. B. et al.:Gastroenterology. 2006;130:323-333〔AYM210035〕
10
Sandborn, W. J. et al.:Gut. 2007;56:1232-1239〔AYM210036〕
11
持田製薬社内資料:海外第Ⅰ相試験
12
持田製薬社内資料:生物学的同等性試験
13
ヒュミラ皮下注40mgシリンジ0.8mL申請資料概要:関節リウマチ患者を対象としたアダリムマブ単回皮下投与時の臨床薬理試験(2008年4月16日承認、CTD 2.7.6.15)
14
ヒュミラ皮下注40mgシリンジ0.8mL申請資料概要:健康成人被験者を対象としたアダリムマブの臨床試験用製剤と市販用製剤の非盲検無作為化並行群間生物学的同等性試験(2008年4月16日承認、CTD 2.7.6.3)
15
ヒュミラ皮下注40mgシリンジ0.8mL申請資料概要:生物学的利用率(2008年4月16日承認、CTD 2.7.1.1.4)
16
ヒュミラ皮下注40mgシリンジ0.8mL申請資料概要:第Ⅱ/Ⅲ相試験における薬物動態の検討(2008年4月16日承認、CTD 2.7.2.2.4(4))
17
ヒュミラ皮下注40mgシリンジ0.8mL申請資料概要:乾癬患者を対象とした日本における薬物動態の検討(2010年1月20日承認、CTD 2.7.2.2.6(1))
18
ヒュミラ皮下注40mgシリンジ0.8mL申請資料概要:日本人強直性脊椎炎患者(2010年10月27日承認、CTD 2.7.2.2.2)
19
ヒュミラ皮下注20mgシリンジ0.4mL、ヒュミラ皮下注40mgシリンジ0.8mL申請資料概要:日本人JIA患者(2011年7月1日承認、CTD 2.7.2.2.2)
20
ヒュミラ皮下注40mgシリンジ0.8mL申請資料概要:日本人腸管型ベーチェット病患者(2013年5月16日承認、CTD 2.7.2.2)
21
ヒュミラ皮下注40mgシリンジ0.8mL申請資料概要:日本人クローン病患者(2010年10月27日承認、CTD 2.7.2.2.2)
22
ヒュミラ皮下注40mgシリンジ0.8mL審査報告書:国内第Ⅲ相試験(2016年6月20日承認、審査報告(1)7.1)
23
ヒュミラ皮下注40mgシリンジ0.8mL審査報告書:国内第Ⅱ/Ⅲ相試験(2013年6月14日承認、審査報告(1)Ⅱ.4.)
24
ヒュミラ皮下注40mgシリンジ0.4mL、同皮下注20mgシリンジ0.2mL、同皮下注80mgシリンジ0.8mL、同皮下注40mgペン0.4mL、同皮下注80mgペン0.8mL申請資料概要:M14-033試験(成人UC患者)(2021年9月27日承認、CTD 2.7.2.2.1)
25
ヒュミラ皮下注40mgシリンジ0.8mL、ヒュミラ皮下注40mgシリンジ0.4mL、ヒュミラ皮下注80mgシリンジ0.8mL審査報告書:臨床薬理試験(2016年9月28日承認、審査報告(1)6.2)
26
ヒュミラ皮下注40mgシリンジ0.8mL申請資料概要:滑液中へのアダリムマブ濃度の移行(2008年4月16日承認、CTD 2.7.2.3.2(2))
27
ヒュミラ皮下注40mgシリンジ0.8mL申請資料概要:代謝(2008年4月16日承認、CTD 2.6.4.5)
28
ヒュミラ皮下注40mgシリンジ0.8mL申請資料概要:排泄(2008年4月16日承認、CTD 2.6.4.6)
29
Ben-Horin, S. et al.:Clin. Gastroenterol. Hepatol. 2010;8:475-476〔AYM210037〕
30
持田製薬社内資料:国際共同第Ⅲ相試験
31
Miyasaka, N. The CHANGE Study Investigators:Mod. Rheumatol. 2008;18:252-262〔AYM210038〕
32
ヒュミラ皮下注40mgシリンジ0.8mL申請資料概要:関節リウマチ患者を対象としたアダリムマブ用量反応性試験(2008年4月16日承認、CTD 2.7.6.19)
33
Takeuchi, T. et al.:Ann. Rheum. Dis. 2014;73:536-543〔AYM210039〕
34
ヒュミラ皮下注40mgシリンジ0.8mL審査報告書:国内第Ⅲ相試験(2012年8月10日承認、審査報告(1)Ⅱ.2.(ii)(1))
35
van de Putte, L. B. A. et al.:Ann. Rheum. Dis. 2004;63:508-516〔AYM210040〕
36
ヒュミラ皮下注40mgシリンジ0.8mL申請資料概要:早期関節リウマチ患者を対象とした2年間の完全ヒト抗TNFα抗体アダリムマブ隔週投与とメトトレキサート毎週投与及びその併用時の前向き多施設二重盲検実薬対照、並行群間試験(2008年4月16日承認、CTD 2.7.6.24)
37
ヒュミラ皮下注40mgシリンジ0.8mL申請資料概要:メトトレキサートを投与された関節リウマチ患者におけるヒト抗TNFモノクローナル抗体D2E7の多施設無作為化二重盲検プラセボ対照試験(2008年4月16日承認、CTD 2.7.6.27)
38
Asahina, A. et al.:J. Dermatol. 2010;37:299-310〔AYM210041〕
39
ヒュミラ皮下注40mgシリンジ0.8mL申請資料概要:慢性局面型皮疹を有する中等症又は重症の日本人乾癬患者(尋常性乾癬)を対象としたアダリムマブの有効性と安全性を検討するプラセボ対照の二重盲検比較試験(2010年1月20日承認、CTD 2.7.6.21)
40
Morita, A. et al.:J. Dermatol. 2018;45:1371-1380〔AYM210042〕
41
Mease, P. J. et al.:Arthritis Rheum. 2005;52:3279-3289〔AYM210043〕
42
ヒュミラ皮下注40mgシリンジ0.8mL申請資料概要:中等症又は重症の活動性関節症性乾癬患者を対象としたヒト抗TNFモノクローナル抗体アダリムマブの安全性及び有効性を検討する第Ⅲ相多施設共同試験(2010年1月20日承認、CTD 2.7.6.25)
43
Kobayashi, S. et al.:Mod. Rheumatol. 2012;22:589-597〔AYM210044〕
44
ヒュミラ皮下注40mgシリンジ0.8mL申請資料概要:日本人強直性脊椎炎患者を対象としたアダリムマブ多施設共同試験(24週間中間報告)(2010年10月27日承認、CTD 2.7.6.6)
45
Imagawa, T. et al.:Clin. Rheumatol. 2012;31:1713-1721〔AYM210045〕
46
ヒュミラ皮下注20mgシリンジ0.4mL、ヒュミラ皮下注40mgシリンジ0.8mL申請資料概要:若年性関節リウマチ患者を対象としたアダリムマブ多施設共同試験(2011年7月1日承認、CTD 2.7.6.2)
47
Lovell, D. J. et al.:N. Engl. J. Med. 2008;359:810-820〔AYM210046〕
48
ヒュミラ皮下注20mgシリンジ0.4mL、ヒュミラ皮下注40mgシリンジ0.8mL申請資料概要:多関節型JIAの小児患者を対象としたアダリムマブの安全性、有効性、薬物動態を評価する多施設共同無作為化二重盲検プラセボ対照試験(2011年7月1日承認、CTD 2.7.6.1)
49
Tanida, S. et al.:Clinical Gastroenterol. Hepatol. 2015;13:940-948〔AYM210047〕
50
ヒュミラ皮下注40mgシリンジ0.8mL申請資料概要:日本人腸管型ベーチェット病患者を対象としたアダリムマブの多施設共同試験(2013年5月16日承認、CTD 2.7.6.4)
51
Watanabe, M. et al.:J. Crohns Colitis. 2012;6:160-173〔AYM210048〕
52
ヒュミラ皮下注40mgシリンジ0.8mL申請資料概要:日本人クローン病患者を対象としたアダリムマブの導入療法における多施設共同無作為化二重盲検プラセボ対照試験(2010年10月27日承認、CTD 2.7.6.4)
53
ヒュミラ皮下注40mgシリンジ0.8mL申請資料概要:日本人クローン病患者を対象としたアダリムマブの維持療法における多施設共同長期投与試験(2010年10月27日承認、CTD 2.7.6.8)
54
ヒュミラ皮下注40mgシリンジ0.8mL申請資料概要:クローン病患者を対象としたヒト抗TNFモノクローナル抗体であるアダリムマブの導入療法における多施設共同無作為化二重盲検プラセボ対照試験(2010年10月27日承認、CTD 2.7.6.5)
55
Sandborn, W. J. et al.:Ann. Intern. Med. 2007;146:829-838〔AYM210049〕
56
Suzuki, Y. et al.:J. Gastroenterol. 2014;49:283-294〔AYM210050〕
57
Reinisch, W. et al.:Gut. 2011;60:780-787〔AYM210051〕
58
ヒュミラ皮下注40mgシリンジ0.8mL審査報告書:海外第Ⅲ相試験(2013年6月14日承認、審査報告(1)Ⅱ.4.(iii))
59
Sandborn, W. J. et al.:Gastroenterology. 2012;142:257-265〔AYM210052〕
60
ヒュミラ皮下注40mgシリンジ0.4mL、同皮下注20mgシリンジ0.2mL、同皮下注80mgシリンジ0.8mL、同皮下注40mgペン0.4mL、同皮下注80mgペン0.8mL申請資料概要:成人の潰瘍性大腸炎患者を対象とした高用量での国際共同第Ⅲ相試験(2021年9月27日承認、CTD 2.7.3.2、2.7.3.3、2.7.4.2)
61
ヒュミラ皮下注40mgシリンジ0.4mL、ヒュミラ皮下注80mgシリンジ0.8mL、ヒュミラ皮下注40mgペン0.4mL、ヒュミラ皮下注80mgペン0.8mL、ヒュミラ皮下注20mgシリンジ0.2mL審査報告書:第Ⅲ相試験(2021年9月27日承認、審査報告(1)7.1)
62
ヒュミラ皮下注40mgシリンジ0.8mL、ヒュミラ皮下注40mgシリンジ0.4mL、ヒュミラ皮下注80mgシリンジ0.8mL審査報告書:第Ⅲ相試験(2016年9月28日承認、審査報告(1)7.1)
63
ヒュミラ皮下注40mgシリンジ0.8mL、ヒュミラ皮下注40mgシリンジ0.4mL、ヒュミラ皮下注80mgシリンジ0.8mL審査報告書:第Ⅲ相試験(2016年9月28日承認、審査報告(1)7.2)
64
持田製薬社内資料:薬理試験-in vitro薬理試験-
65
持田製薬社内資料:薬理試験-ヒトTNFαトランスジェニックマウスモデルにおける有効性の検討-
66
ヒュミラ皮下注40mgシリンジ0.8mL申請資料概要:効力を裏付けるin vitro試験(2008年4月16日承認、CTD 2.6.2.2(1))
67
Salfeld, J. et al.:Arthritis Rheum. 1998;41:S57〔AYM210053〕