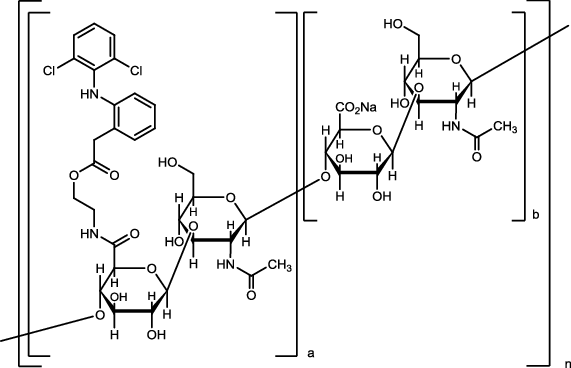
1
生化学工業(株)社内資料:ラットを用いた薬物動態試験(2021年3月23日承認、CTD2.6.4.4.4)
2
生化学工業(株)社内資料:ラットを用いた薬物動態試験(2021年3月23日承認、CTD2.6.4.6.3)
3
堀 誠治.:日本化学療法学会雑誌. 2004;52:293-303.
4
生化学工業(株)社内資料:第Ⅰ相試験(613/1111試験)(2021年3月23日承認、CTD2.7.6.1)
5
生化学工業(株)社内資料:ウサギを用いた薬物動態試験(2021年3月23日承認、CTD2.6.4.4.2.1)
6
生化学工業(株)社内資料:ラットを用いた薬物動態試験(2021年3月23日承認、CTD2.6.4.6.1.1)
7
生化学工業(株)社内資料:国内第Ⅲ相試験(613/1031試験)(2021年3月23日承認、CTD2.7.6.4)
8
生化学工業(株)社内資料:国内第Ⅲ相試験(613/1033試験)(2021年3月23日承認、CTD2.7.6.5)
9
生化学工業(株)社内資料:関節炎モデルラットを用いた薬理試験(鎮痛作用)(2021年3月23日承認、CTD2.6.2.2.2.1)
10
生化学工業(株)社内資料:関節炎モデルラットを用いた薬理試験(抗炎症作用)(2021年3月23日承認、CTD2.6.2.2.2.3)
11
生化学工業(株)社内資料:関節炎モデルウサギを用いた薬理試験(2021年3月23日承認、CTD2.6.2.2.2.6)
12
生化学工業(株)社内資料:ヒト軟骨細胞を用いた薬理試験(2021年3月23日承認、CTD2.6.2.2.1.2)
13
生化学工業(株)社内資料:ヒト滑膜細胞を用いた薬理試験(2021年3月23日承認、CTD2.6.2.2.1.3)