1
Kimball, A.B., et al.: Br. J. Dermatol. 2015; 173: 1183-1190
2
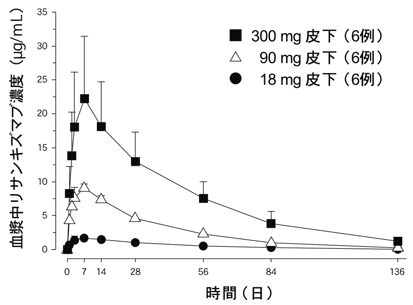
社内資料:健康成人における第Ⅰ相試験(2019年3月26日承認、CTD2.7.2.2)
3
社内資料:尋常性乾癬患者第Ⅱ/Ⅲ相試験、膿疱性乾癬又は乾癬性紅皮症患者第Ⅲ相試験(2019年3月26日承認、CTD2.7.2.2)
4
社内資料:掌蹠膿疱症患者第Ⅲ相試験(2023年5月25日承認、CTD2.7.2.2)
5
社内資料:母集団薬物動態解析報告書(2019年3月26日承認、CTD2.7.2.3)
6
社内資料:CYP基質薬物との相互作用試験(2019年3月26日承認、CTD 2.7.2.1)
7
社内資料:生物学的同等性試験(2021年9月22日承認、CTD 2.7.1.2)
8
Gordon, K.B., et al.: Lancet 2018; 392: 650-661
9
社内資料:IL-23に対する結合親和性(2019年3月26日承認、CTD2.6.2.2)
10
社内資料:in vitro中和作用(2019年3月26日承認、CTD2.6.2.1)
11
社内資料:in vivo中和作用(2019年3月26日承認、CTD2.6.2.2)