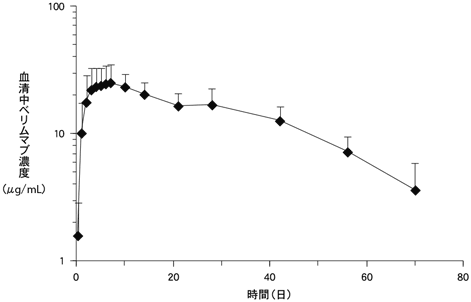
1
Shida Y,et al.:J Clin Pharm Ther.2014;39:97-101
2
Furie RA,et al.:Arthritis Rheum.2009;61:1143-1151
3
社内資料:SLE患者を対象とした国際共同第Ⅲ相二重盲検並行群間比較試験(皮下注用製剤、BEL112341試験)(2017年9月27日承認、CTD2.7.6)
4
La Cava A.:Clin Immunol.2013;148:322-327
5
Zhao LD,et al.:Lupus.2010;19:1534-1549
6
Petri M,et al.:Arthritis Rheum.2008;58:2453-2459
7
Baker KP,et al.:Arthritis Rheum.2003;48:3253-3265
8
社内資料:SLE患者を対象とした国際共同第Ⅲ相二重盲検並行群間比較試験(点滴静注用製剤、BEL113750試験)(2017年9月27日承認、CTD2.7.6)
9
社内資料:SLE患者を対象とした海外第Ⅲ相二重盲検並行群間比較試験(点滴静注用製剤、BEL110751試験)(2017年9月27日承認、CTD2.7.6)