1
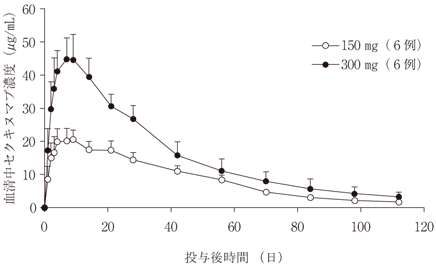
社内資料:乾癬患者を対象とした母集団薬物動態解析 (2014年12月26日承認、CTD2.7.2-2.4)[20145119]
2
Ohtsuki, M. et al.: J. Dermatol. 2014 ; 41(12), 1039-1046[20145357]
3
社内資料:重症の局面型皮疹を有する小児乾癬患者を対象とした国際共同第Ⅲ相試験(A2310試験)(2021年9月27日承認、CTD2.7.3-3.3.3, CTD2.7.6-4.1)[20210074]
4
社内資料:中等症又は重症の局面型皮疹を有する小児乾癬患者を対象とした海外第Ⅲ相試験(A2311試験)(2021年9月27日承認、CTD2.7.6-4.1)[20210075]
5
Imafuku, S. et al.:J. Dermatol. 2016 ; 43(9), 1011-1017[20160759]
6
社内資料:活動性強直性脊椎炎患者を対象としたセクキヌマブ国内第Ⅲ相試験(H1301試験)(2018年12月21日承認、CTD2.7.6-4.2.1)[20180629]
7
社内資料:X線基準を満たさない体軸性脊椎関節炎患者を対象としたセクキヌマブ国際共同第Ⅲ相試験(H2315試験)(2020年8月21日承認、CTD2.7.6-4.1.1)[20200390]
8
社内資料:ヒト線維芽細胞様滑膜細胞におけるIL-6産生に対するセクキヌマブの中和作用 (2014年12月26日承認、CTD2.6.2-2.3.1)[20145120]
9
社内資料:ヒト皮膚線維芽細胞におけるIL-6産生に対するセクキヌマブの中和作用 (2014年12月26日承認、CTD2.6.2-2.3.3)[20145121]
10
社内資料:ヒトIL-17A産生細胞の注入によるマウス膝関節腫脹に対するセクキヌマブの抑制作用 (2014年12月26日承認、CTD2.6.2-2.4.1)[20145122]
11
社内資料:ヒトIL-17A産生細胞誘発によるマウス空気嚢への好中球遊走に対するセクキヌマブの抑制作用 (2014年12月26日承認、CTD2.6.2-2.4.2)[20145123]