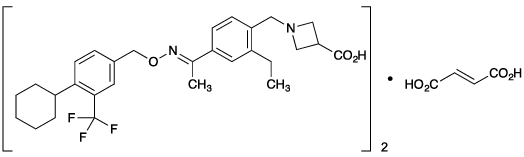
1
社内資料:日本人の薬物動態試験(2020年6月29日承認、CTD2.7.6-2.1.1)[20200203]
2
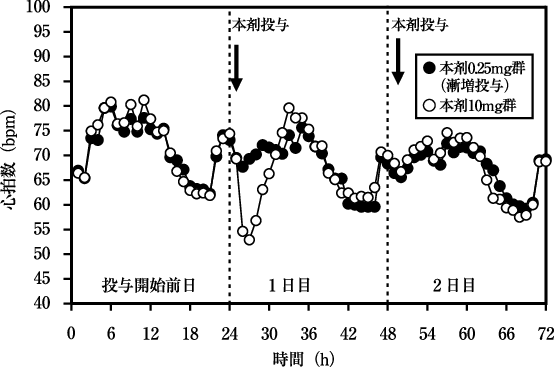
社内資料:反復投与時の薬物動態試験(2020年6月29日承認、CTD2.7.2-2.2.1.3)[20200204]
3
Shakeri-Nejad K, et al.:Clin Ther. 2015;37(11):2489-2505[20200205]
4
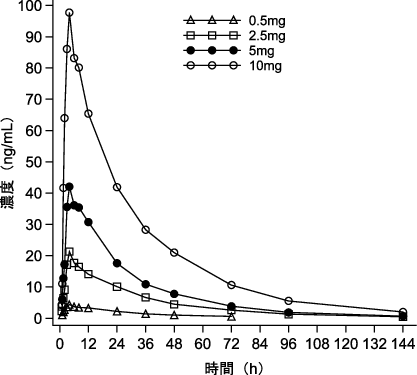
社内資料:第Ⅲ相試験での血漿中濃度(2020年6月29日承認、CTD2.7.6-4.1.1)[20200206]
5
社内資料:絶対バイオアベイラビリティ試験(2020年6月29日承認、CTD2.7.6-1.1.1)[20200207]
6
社内資料:食事の影響試験(2020年6月29日承認、CTD2.7.6-1.2.2)[20200208]
7
社内資料:血球移行の評価試験(2020年6月29日承認、CTD2.7.2-2.1)[20200209]
8
社内資料:マウスEAEに対する急性期投与での効果(経口)(2020年6月29日承認、CTD2.6.2-2.3.2.2)[20200223]
9
Glaenzel U, et al.:Drug Metab Dispos. 2018;46(7):1001-1013[20200210]
10
社内資料:ADME試験(2020年6月29日承認、CTD2.7.6-2.1.5)[20200212]
11
Gardin A, et al.:Int J Clin Pharmacol Ther. 2017;55(1):54-65[20200213]
12
Shakeri-Nejad K, et al.:Int J Clin Pharmacol Ther. 2017;55(1):41-53[20200214]
13
Gardin A, et al.:Clin Pharmacokinet. 2019;58:349-361[20200215]
14
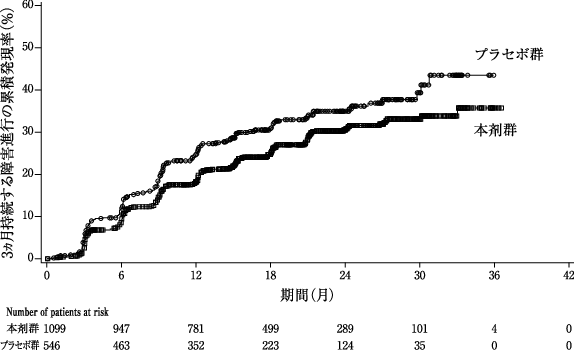
社内資料:第Ⅲ相試験の母集団薬物動態解析(2020年6月29日承認、CTD2.7.2-3.1.8.2)[20200211]
15
社内資料:特別な患者集団での薬物動態(2020年6月29日承認、CTD2.7.2-1.2.1.3)[20200220]
16
社内資料:第Ⅰ相及び第Ⅱ相試験の母集団薬物動態解析(2020年6月29日承認、CTD2.7.2-3.1.8.1)[20200216]
17
Gardin A, et al.:Eur J Clin Pharmacol. 2018;74(12):1593-1604[20200217]
18
Biswal S, et al.:Int. Journal of Clinical Pharmacology and Therapeutics. 2014;52(11):996-1004[20200218]
19
Biswal S, et al.:Int. Journal of Clinical Pharmacology and Therapeutics. 2015;53:855-865[20200219]
20
Gergely P, et al.:Br J Pharmacol. 2012;167(5):1035-47. [20200229]
21
Bigaud M, et al.:Neurology, 2018;90(Suppl.15):P3.404. [20200222]
22
Briard E, et al.:ChemMedChem. 2015;10(6):1008-18. [20200224]
23
O'Sullivan C, et al.:J Neuroinflammation. 2016;13:31. [20200225]
24
Jackson SJ, et al.:J Neuroinflammation. 2011;8:76. [20200226]
25
Mannioui A, et al.:Mult Scler. 2018;24(11):1421-32. [20200227]
26
Gentile A, et al.:J Neuroinflammation. 2016;13(1):207[20200228]








 T
T