1
D.Y.Mitchell, et al.:Br.J.Clin.Pharmacol.2000;49:215-222.
2
MID-NET®を用いた調査結果の概要(MID-NET®を用いたビスホスホネート製剤の腎機能障害患者における低カルシウム血症のリスク評価に関するデータベース調査):
https://www.pmda.go.jp/files/000249186.pdf
https://www.pmda.go.jp/files/000249186.pdf
3
Y.Ogura, et al.:J.Bone Miner.Metab.2004;22:111-119.
4
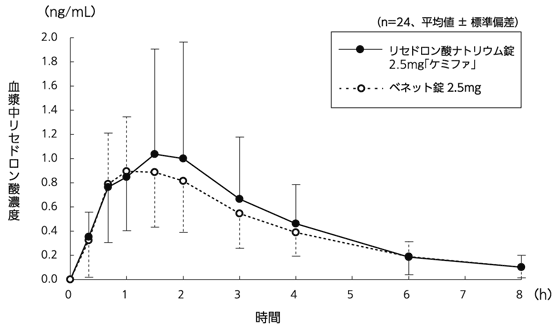
高齢者における体内動態(アクトネル錠2.5mg・ベネット錠2.5mg:2002年1月17日承認、申請資料概要へ.3.(3))
5
岸本英彰 他:Osteoporosis Japan.2002;10:61-82.
6
患者における体内動態(アクトネル錠2.5mg・ベネット錠2.5mg:2002年1月17日承認、申請資料概要へ.3.(2))
7
日本薬品工業株式会社:生物学的同等性に関する資料(社内資料)
8
Y.Ogura, et al.:J.Bone Miner.Metab.2004;22:120-126.
9
飲料の影響について(アクトネル錠2.5mg・ベネット錠2.5mg:2002年1月17日、審査報告書)
10
腎機能障害患者における体内動態(アクトネル錠2.5mg・ベネット錠2.5mg:2002年1月17日承認、申請資料概要へ.3.(6))
11
M.Shiraki, et al.:Osteoporos.Int.2003;14:225-234.
12
M.Fukunaga, et al.:Osteoporos.Int.2002;13:971-979.
13
串田一博 他:Osteoporosis Japan.2002;10:85-97.
14
国内における臨床成績(アクトネル錠2.5mg・ベネット錠2.5mg:2002年1月17日承認、申請資料概要ト.4.(1))
15
K.Kushida, et al.:J.Bone Miner.Metab.2004;22:469-478.
16
S.T.Harris, et al.:J.Am.Med.Assoc.1999;282:1344-1352.
17
J.-Y.Reginster, et al.:Osteoporos.Int.2000;11:83-91.
18
第Ⅲ相比較試験(アクトネル錠2.5mg・ベネット錠2.5mg:2002年1月17日承認、申請資料概要ト.2.(1))
19
I.Fogelman, et al.:J.Clin.Endocrinol.Metab.2000;85:1895-1900.
20
腰椎骨密度変化率を主要評価項目とした試験成績の比較(アクトネル錠2.5mg・ベネット錠2.5mg:2002年1月17日承認、申請資料概要ト.3.(1))
21
D.Y.Mitchell, et al.:J.Clin.Pharmacol.2000;40:258-265.
22
薬物動態の比較(アクトネル錠2.5mg・ベネット錠2.5mg:2002年1月17日承認、申請資料概要ト.3.(4))
23
作用機序に関する検討(アクトネル錠2.5mg・ベネット錠2.5mg:2002年1月17日承認、申請資料概要ホ.1.(6))
24
卵巣摘除モデルに対する作用(アクトネル錠2.5mg・ベネット錠2.5mg:2002年1月17日承認、申請資料概要ホ.1.(1).1))
25
LI.Mosekilde, et al.:Bone.2000;27:639-645.
26
骨密度と骨強度の相関性に関する検討(アクトネル錠2.5mg・ベネット錠2.5mg:2002年1月17日承認、申請資料概要ホ.1.(4).1))
27
骨の石灰化に関する作用(アクトネル錠2.5mg・ベネット錠2.5mg:2002年1月17日承認、申請資料概要ホ.1.(4).2))
28
ビーグル犬骨折モデルにおける骨折治癒に対する作用(アクトネル錠2.5mg・ベネット錠2.5mg:2002年1月17日承認、申請資料概要ホ.1.(5))