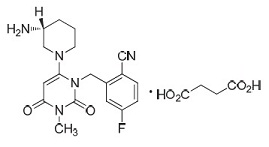
1
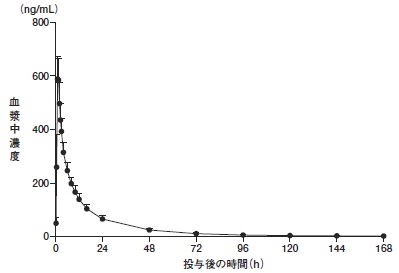
トレラグリプチンの薬物動態試験成績①(2015年3月26日承認:CTD 2.7.6.3)
2
トレラグリプチンの薬物動態試験成績②(2015年3月26日承認:CTD 2.7.6.4)
3
トレラグリプチンの薬物動態試験成績③(2015年3月26日承認:CTD 2.7.6.1)
4
トレラグリプチンの蛋白結合に関する検討(2015年3月26日承認:CTD 2.6.4.4)
5
トレラグリプチンの代謝に関する検討(2015年3月26日承認:CTD 2.6.4.5)
6
トレラグリプチンの臨床試験成績①(2015年3月26日承認:CTD 2.7.2.1)
7
トレラグリプチンの排泄に関する検討(2015年3月26日承認:CTD 2.7.2.2)
8
腎機能障害患者における薬物動態試験成績(2015年3月26日承認:CTD 2.7.6.8)
9
肝機能障害患者における薬物動態試験成績(2015年3月26日承認:CTD 2.7.6.9)
10
グリメピリドとの薬物間相互作用試験成績(2015年3月26日承認:CTD 2.7.6.10)
11
メトホルミンとの薬物間相互作用試験成績(2015年3月26日承認:CTD 2.7.6.11)
12
カフェイン、トルブタミド、デキストロメトルファン、ミダゾラムとの薬物間相互作用試験成績(2015年3月26日承認:CTD 2.7.6.12)
13
トレラグリプチンの臨床試験成績②(2015年3月26日承認:CTD 2.7.6.13)
14
トレラグリプチンの臨床試験成績③(2015年3月26日承認:CTD 2.7.6.16)
15
トレラグリプチンの臨床試験成績④(2015年3月26日承認:CTD 2.7.6.17)
16
トレラグリプチンの臨床試験成績⑤(2015年3月26日承認:CTD 2.7.6.18)
17
トレラグリプチンの臨床試験成績⑥(2019年8月21日承認:CTD 2.7.6.2)
18
社内資料:トレラグリプチンの製造販売後臨床試験成績
19
トレラグリプチンのQT/QTc間隔に関する検討(2015年3月26日承認:CTD 2.7.6.7)
20
トレラグリプチンの耐糖能改善作用に関する検討(2015年3月26日承認:CTD 2.6.2.2)
21
トレラグリプチンの酵素阻害活性に関する検討(2015年3月26日承認:CTD 2.6.2.2)





 D389
D389