1
前芝良宏 他:薬理と治療. 1996;24:2597-2617
2
Lewis J.D. et al.:JAMA. 2015;314:265-277
3
Korhonen P. et al.:BMJ. 2016;354:i3903
4
Azoulay L. et al.:BMJ. 2012;344:e3645
5
Hsiao F.Y. et al.:Drug Safety. 2013;36:643-649
6
Saez E. et al.:Nature Medicine. 1998;4:1058-1061
7
Lefebvre A.M. et al.:Nature Medicine. 1998;4:1053-1057
8
平賀興吾:臨牀と研究. 1997;74:1184-1201
9
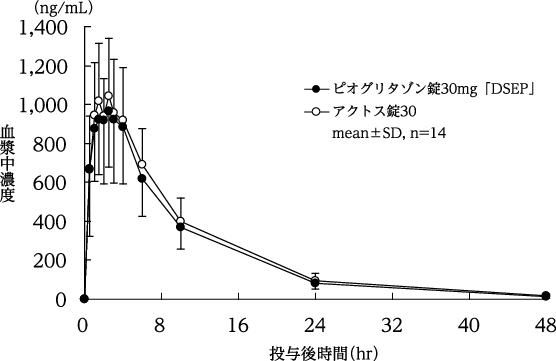
単回投与における検討(アクトス錠:1999年9月22日承認、申請資料概要ヘ.3.1.2.1.1)
10
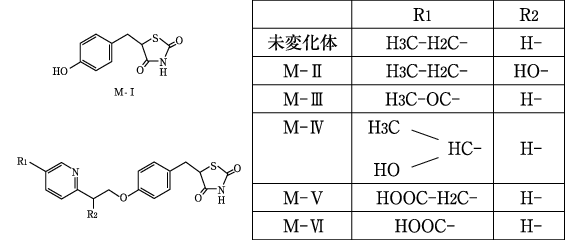
代謝(アクトス錠:1999年9月22日承認、申請資料概要ヘ.2.3.1)
11
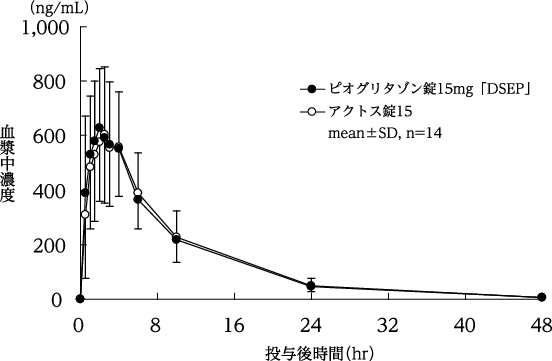
社内資料:生物学的同等性に関する資料
12
代謝(アクトス錠:1999年9月22日承認、申請資料概要ヘ.総括)
13
東 純一 他:臨牀と研究. 1997;74:1627-1637
14
播 穣治 他:臨牀と研究. 1997;74:1217-1226
15
兼子俊男 他:臨牀と研究. 1997;74:1540-1556
16
薬物相互作用試験(アクトス錠:2008年12月22日承認、審査報告書)
17
臨床試験成績のまとめ(アクトス錠:1999年9月22日承認、申請資料概要ト.2.1.1)
18
兼子俊男 他:臨牀と研究. 1997;74:1250-1277
19
兼子俊男 他:臨牀と研究. 1997;74:1278-1306
20
兼子俊男 他:臨牀と研究. 1997;74:1491-1514
21
兼子俊男 他:臨牀と研究. 1997;74:1515-1539
22
高科成良 他:臨牀と研究. 1997;74:1614-1626
23
兼子俊男 他:臨牀と研究. 1997;74:1557-1588
24
兼子俊男 他:臨牀と研究. 1997;74:1589-1613
25
第Ⅲ相二重盲検比較試験(アクトス錠:2002年6月17日承認、審査報告書)
26
第Ⅲ相試験(アクトス錠:2008年12月22日承認、審査報告書)
27
第Ⅲ相二重盲検比較試験(アクトス錠:2009年3月24日承認、審査報告書)
28
第十八改正日本薬局方解説書 廣川書店 2021年:C4226-4232
29
Sugiyama Y. et al.:Arzneimittelforschung. 1990;40:263-267
30
Sugiyama Y. et al.:Arzneimittelforschung. 1990;40:436-440
31
Hayakawa T. et al.:Biochem.Biophys.Res.Commun. 1996;223:439-444
32
Murase K. et al.:Diabetologia. 1998;41:257-264
33
池田 衡 他:薬理と治療. 1997;25:337-343
34
Kawamori R. et al.:Diabetes Research and Clinical Practice. 1998;41:35-43
35
Yamasaki Y. et al.:Tohoku J.Exp.Med. 1997;183:173-183