1
David Bodensteiner, et al. Genet Med. 2008, 10(5) : 353-358.
2
ファブラザイム®点滴静注用 : ラット生殖発生毒性試験(2004年1月29日承認、CTD M2.6.6.6)
3
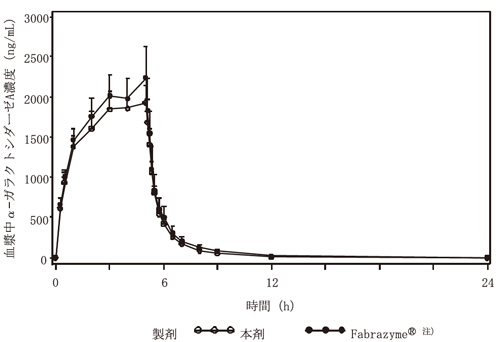
社内資料 : JR-051の健康成人男性を対象とした第Ⅰ相臨床試験
4
ファブラザイム®点滴静注用 : AGAL-007-99試験(2004年1月29日承認、CTD M2.7.6.2)
5
ファブラザイム®点滴静注用 : マウスにおけるr-hαGALの体内分布(2004年1月29日承認、CTD M2.6.4.1)
6
ファブラザイム®点滴静注用 : ノックアウトマウスの組織におけるr-hαGALの安定性(2004年1月29日承認、CTD M2.6.4.4.3)
7
社内資料 : JR-051のファブリー病を対象とした第Ⅱ/Ⅲ相臨床試験
8
ファブラザイム®点滴静注用 : AGAL-1-002-98試験(2004年1月29日承認、CTD M2.7.6.3)
9
Dominique P. Germain, et al. J Am Soc Nephrol. 2007, 18 : 1547-1557.
10
Maryam Banikazemi, et al. Ann Intern Med. 2007, 146 : 77-86.
11
社内資料 : JR-051の薬理試験
12
Yiannis A. Ioannou, et al. Am J Hum Genet. 2001, 68 : 14-25.