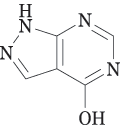
| 外形 表面 |  |
|---|---|
| 裏面 |  |
| 側面 |  |
| 直径 | 6.5mm |
| 厚さ | 2.2mm |
| 重量 | 100mg |
| 色調・剤形 | 白色〜微黄白色素錠 |
| 識別コード | TKS50 |
| 外形 表面 |  |
|---|---|
| 裏面 |  |
| 側面 |  |
| 直径 | 8.5mm |
| 厚さ | 4.0mm |
| 重量 | 240mg |
| 色調・剤形 | 白色素錠 |
| 識別コード | TKS100 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| メルカプトプリン(6-MP) アザチオプリン | 骨髄抑制等の副作用を増強する。 これらの薬剤の用量を1/3〜1/4に減量すること。 | 本剤がアザチオプリンの代謝酵素であるキサンチンオキシダーゼを阻害する。 その結果メルカプトプリンの血中濃度が上昇する。 |
| ビダラビン | ビダラビンの作用を増強し、幻覚、振戦、神経障害等が発現したとの報告がある。 副作用の発現に注意すること。 | 本剤がビダラビンの代謝を抑制し、ビダラビンの作用を増強すると報告されている。 |
| クマリン系抗凝血剤(ワルファリンカリウム) | クマリン系抗凝血剤の作用を増強するとの報告がある。 凝固能の変動に注意し、クマリン系抗凝血剤の投与量の減量あるいは投与間隔の延長を考慮すること。 | 本剤による肝代謝酵素活性の低下作用により、クマリン系抗凝血剤の代謝を阻害するためクマリン系抗凝血剤の半減期が延長すると報告されている。 |
| クロルプロパミド | クロルプロパミドの作用を増強する。血糖値の変動に注意し、クロルプロパミドの投与量の減量あるいは投与間隔の延長を考慮すること。 | 尿細管分泌の競合によりクロルプロパミドの半減期が延長すると報告されている。 |
| シクロホスファミド | 骨髄抑制が発現したとの報告がある。 定期的に血液検査を行い、白血球減少等の副作用の発現に注意すること。 | 本剤又は本剤の代謝物がシクロホスファミドの肝代謝を阻害する、又は、シクロホスファミド腎排泄を競合阻害すると報告されている。 |
| シクロスポリン | シクロスポリンの血中濃度が上昇し、腎機能低下が発現したとの報告がある。 シクロスポリンの投与量に注意すること。 | 本剤がシクロスポリンの肝代謝を阻害するためシクロスポリンの血中濃度が上昇すると報告されている。 |
| フェニトイン | フェニトインの血中濃度が上昇し、嗜眠が発現したとの報告がある。 フェニトインの投与量に注意すること。 | 本剤がフェニトインの肝代謝を阻害するためフェニトインの血中濃度が上昇すると報告されている。 |
| キサンチン系薬剤(テオフィリン等) | キサンチン系薬剤(テオフィリン等)の血中濃度が上昇する。 キサンチン系薬剤の投与量に注意すること。 | 本剤がテオフィリンの代謝酵素であるキサンチンオキシダーゼを阻害するためテオフィリンの血中濃度が上昇すると報告されている。 |
| ジダノシン | 健康成人及びHIV患者において、ジダノシンのCmax及びAUCが2倍に上昇したとの報告がある。 ジダノシンの投与量に注意すること。 なお、ジダノシンの半減期には影響はみられていない。 | 本剤がジダノシンの代謝酵素であるキサンチンオキシダーゼを阻害するため、ジダノシンの血中濃度が上昇すると考えられる。 |
| ペントスタチン | 重症の過敏反応(過敏性血管炎)が発現したとの報告がある。 | 機序は不明である。 |
| カプトプリル | 過敏症状(Stevens-Johnson症候群、関節痛等)が発現したとの報告がある。 | 機序は不明である。 特に腎障害のある患者では注意すること。 |
| ヒドロクロロチアジド | 重症の過敏反応(悪寒、全身性の皮疹等)が発現したとの報告がある。 | 機序は不明である。 |
| アンピシリン | 発疹の発現が増加するとの報告がある。 | 機序は不明であるが、本剤又は高尿酸血症によりアンピシリンの過敏反応が増強される可能性が報告されている。 |
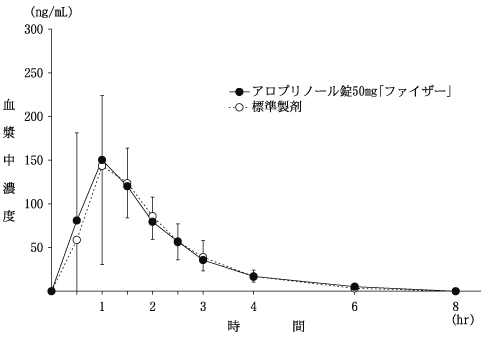
| AUC0-8hr (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | |
| アロプリノール錠50mg「ファイザー」 | 306.50±71.33 | 185.12±82.25 | 1.14±0.36 |
| 標準製剤 | 294.34±91.00 | 187.02±80.61 | 1.32±0.46 |