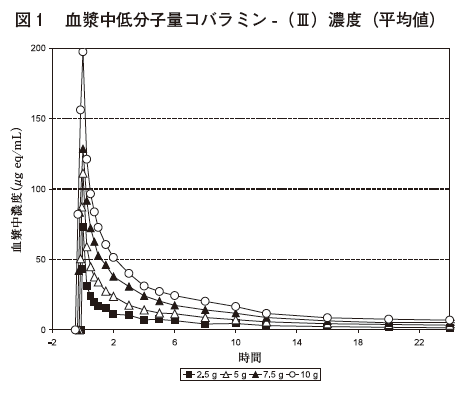
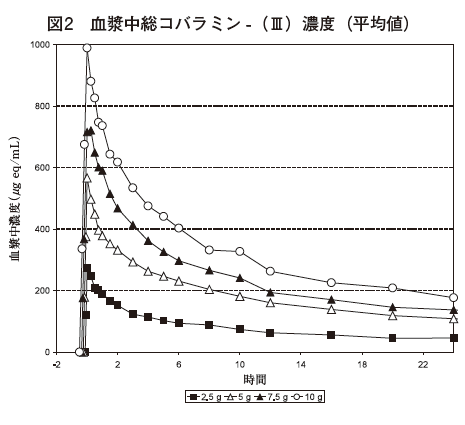
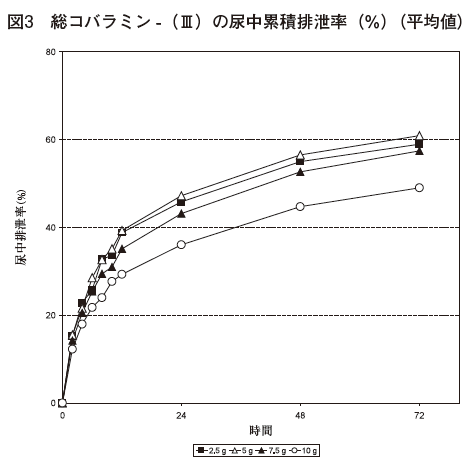
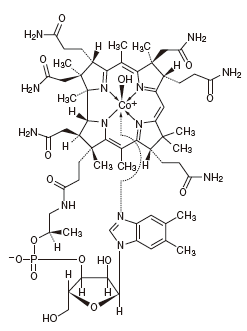
1
Breton D,et al.:Arch Fr Pediatr. 1993 Jan;50(1):43-5.
2
Sutter M,et al.:J Med Toxicol. 2010 Jun;6(2):165-7.
3
社内資料:Uhl W,et al.:健康成人における薬物動態
4
Uhl W,et al.:Clin Toxicol (Phila). 2006;44 Suppl 1:17-28.
5
Borron SW,et al.:Ann Emerg Med. 2007 Jun;49(6):794-801.
6
Borron SW,et al.:Am J Emerg Med. 2007 Jun;25(5):551-8.
7
社内資料:Galleman D,et al.:ヒドロキソコバラミンの作用機序
8
Borron SW,et al.:Clin Toxicol (Phila). 2006;44 Suppl 1:5-15.