1
Brewer GJ, et al. Harrison's Principles of Internal Medicine. 20th Edition. McGraw-Hill. 2018: 2982-4
2
Brewer GJ, et al. Hepatology. 2000; 31(2): 364-70
3
Keen CL, et al. Drug-Nutr Interact. 1983; 2(1): 17-34
4
Cohen NL, et al. Drug-Nutr Interact. 1983; 2(3): 203-10
5
Lewis MR, et al. J Toxicol Clin Toxicol. 1998; 36: 99-101
6
Cowan GAB. Br Med J. 1947; 1: 451-2
7
Burkhart KK, et al. Ann Emerg Med. 1990; 19(10): 1167-70
8
社内資料:ウィルソン病に対する国内第III相試験(2008年1月25日承認、申請資料概要2.7.6(10))
9
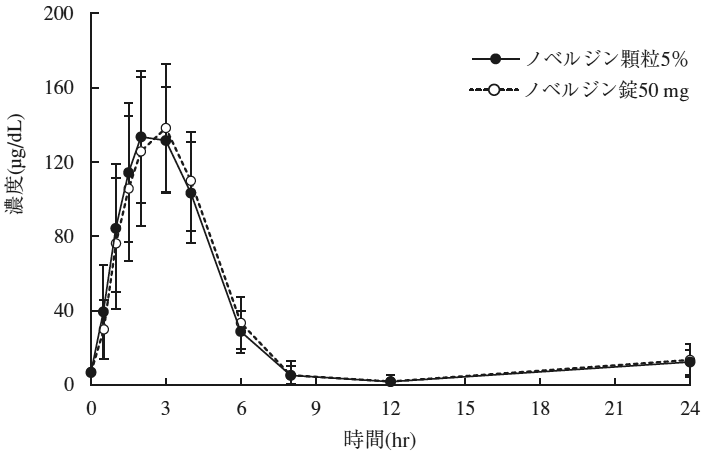
社内資料:錠剤と顆粒剤の生物学的同等性試験(2021年1月22日承認、申請資料概要2.7.6.1)
10
社内資料:低亜鉛血症に対する国内第III相二重盲検比較試験(2017年3月24日承認、申請資料概要2.7.6.1)
11
社内資料:低亜鉛血症に対する国内第III相用量増減法確認試験(2017年3月24日承認、申請資料概要2.7.6.2)
12
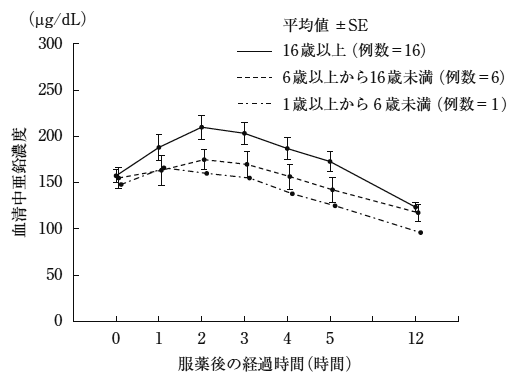
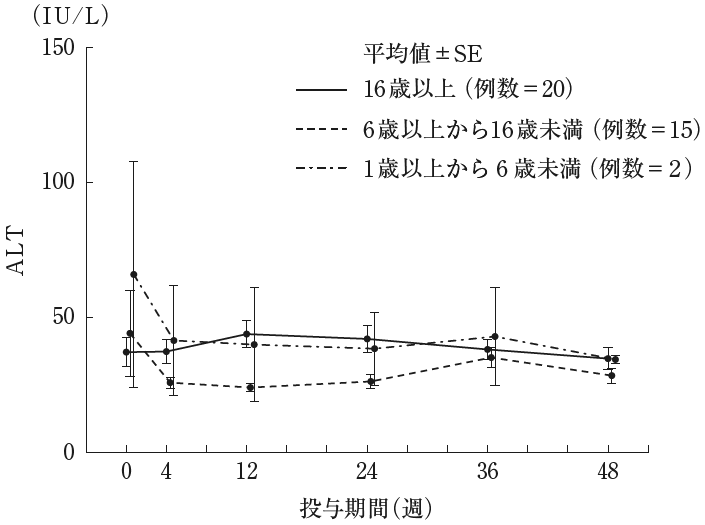
社内資料:小児低亜鉛血症に対する国内第III相試験(2021年1月22日承認、申請資料概要2.7.6.2)
13
Yuzbasiyan-Gurkan V, et al. J Lab Clin Med. 1992; 120(3): 380-6
14
Lee DY, et al. J Lab Clin Med. 1989; 114(6): 639-45
15
Sunar F, et al. Pak J Pharm Sci, 2009; 22: 150-4
16
Riggio O, et al. Hepatology. 1992; 16: 785-9
17
Gandhi MS, et al. J Cardiovasc Pharmacol. 2008; 52: 245-52