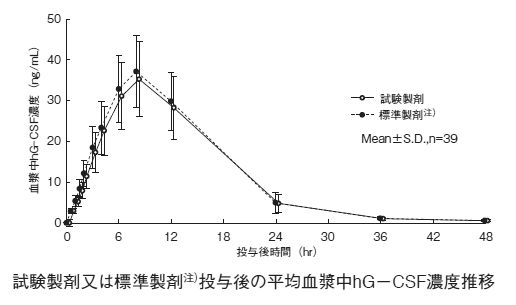
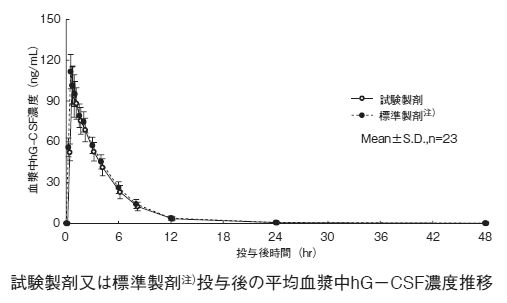
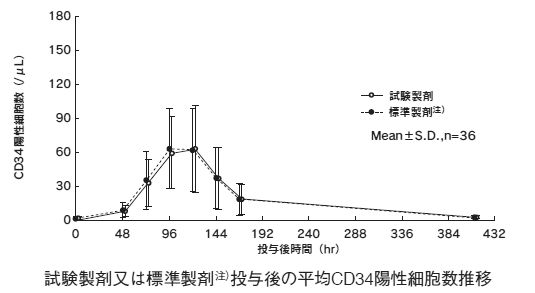
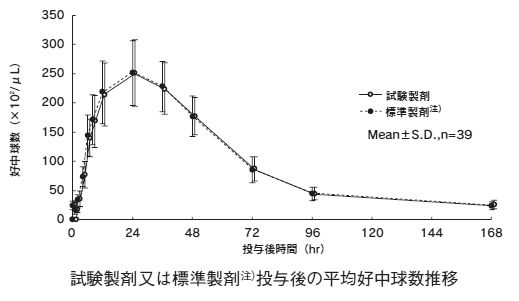
造血幹細胞の末梢血中への動員
同種及び自家末梢血幹細胞採取時のフィルグラスチム(遺伝子組換え)[後続1]単独投与による動員
成人・小児
通常、フィルグラスチム(遺伝子組換え)[後続1]400μg/m2を1日1回又は2回に分割し、5日間連日又は末梢血幹細胞採取終了時まで連日皮下投与する。この場合、末梢血幹細胞採取はフィルグラスチム(遺伝子組換え)[後続1]投与開始後4〜6日目に施行する。
ただし、末梢血幹細胞採取終了前に白血球数が50,000/mm3以上に増加した場合は減量する。減量後、白血球数が75,000/mm3に達した場合は投与を中止する。
自家末梢血幹細胞採取時のがん化学療法剤投与終了後のフィルグラスチム(遺伝子組換え)[後続1]投与による動員
成人・小児
通常、がん化学療法剤投与終了翌日又はがん化学療法により好中球数が最低値を経過後、フィルグラスチム(遺伝子組換え)[後続1]400μg/m2を1日1回又は2回に分割し、末梢血幹細胞採取終了時まで連日皮下投与する。
ただし、末梢血幹細胞採取終了前に白血球数が50,000/mm3以上に増加した場合は減量する。減量後、白血球数が75,000/mm3に達した場合は投与を中止する。
なお、いずれの場合も状態に応じて適宜減量する。
造血幹細胞移植時の好中球数の増加促進
成人・小児
通常、造血幹細胞移植施行翌日ないし5日後からフィルグラスチム(遺伝子組換え)[後続1]300μg/m2を1日1回点滴静注する。
ただし、好中球数が5,000/mm3以上に増加した場合は、症状を観察しながら投与を中止する。
なお、本剤投与の中止時期の指標である好中球数が緊急時等で確認できない場合には、白血球数の半数を好中球数として推定する。
なお、いずれの場合も年齢・症状により適宜増減する。
がん化学療法による好中球減少症
急性白血病
成人・小児
通常、がん化学療法剤投与終了後(翌日以降)で骨髄中の芽球が十分減少し末梢血液中に芽球が認められない時点から、フィルグラスチム(遺伝子組換え)[後続1]200μg/m2を1日1回静脈内投与(点滴静注を含む)する。出血傾向等の問題がない場合はフィルグラスチム(遺伝子組換え)[後続1]100μg/m2を1日1回皮下投与する。
ただし、好中球数が最低値を示す時期を経過後5,000/mm3に達した場合は投与を中止する。
悪性リンパ腫、小細胞肺癌、胚細胞腫瘍(睾丸腫瘍、卵巣腫瘍など)、神経芽細胞腫、小児がん
成人・小児
通常、がん化学療法剤投与終了後(翌日以降)から、フィルグラスチム(遺伝子組換え)[後続1]50μg/m2を1日1回皮下投与する。出血傾向等により皮下投与が困難な場合はフィルグラスチム(遺伝子組換え)[後続1]100μg/m2を1日1回静脈内投与(点滴静注を含む)する。
ただし、好中球数が最低値を示す時期を経過後5,000/mm3に達した場合は投与を中止する。
その他のがん腫
成人・小児
通常、がん化学療法により好中球数1,000/mm3未満で発熱(原則として38℃以上)あるいは好中球数500/mm3未満が観察された時点から、フィルグラスチム(遺伝子組換え)[後続1]50μg/m2を1日1回皮下投与する。出血傾向等により皮下投与が困難な場合はフィルグラスチム(遺伝子組換え)[後続1]100μg/m2を1日1回静脈内投与(点滴静注を含む)する。また、がん化学療法により好中球数1,000/mm3未満で発熱(原則として38℃以上)あるいは好中球数500/mm3未満が観察され、引き続き同一のがん化学療法を施行する症例に対しては、次回以降のがん化学療法施行時には好中球数1,000/mm3未満が観察された時点から、フィルグラスチム(遺伝子組換え)[後続1]50μg/m2を1日1回皮下投与する。出血傾向等により皮下投与が困難な場合はフィルグラスチム(遺伝子組換え)[後続1]100μg/m2を1日1回静脈内投与(点滴静注を含む)する。
ただし、好中球数が最低値を示す時期を経過後5,000/mm3に達した場合は投与を中止する。
なお、本剤投与の開始時期及び中止時期の指標である好中球数が緊急時等で確認できない場合には、白血球数の半数を好中球数として推定する。
なお、いずれの場合も年齢・症状により適宜増減する。
ヒト免疫不全ウイルス(HIV)感染症の治療に支障を来す好中球減少症
成人
通常、好中球数が1,000/mm3未満のとき、フィルグラスチム(遺伝子組換え)[後続1]200μg/m2を1日1回点滴静注する。
ただし、投与期間は2週間を目安とするが、好中球数が3,000/mm3以上に増加した場合は、症状を観察しながら減量、あるいは投与を中止する。
小児
好中球数が1,000/mm3未満のとき、フィルグラスチム(遺伝子組換え)[後続1]200μg/m2を1日1回点滴静注する。
ただし、投与期間は2週間を目安とするが、好中球数が3,000/mm3以上に増加した場合は、症状を観察しながら減量、あるいは投与を中止する。
なお、いずれの場合も年齢・症状により適宜増減する。
骨髄異形成症候群に伴う好中球減少症
成人
通常、好中球数が1,000/mm3未満のとき、フィルグラスチム(遺伝子組換え)[後続1]100μg/m2を1日1回点滴静注する。
ただし、好中球数が5,000/mm3以上に増加した場合は、症状を観察しながら減量、あるいは投与を中止する。
なお、いずれの場合も年齢・症状により適宜増減する。
再生不良性貧血に伴う好中球減少症
成人
通常、好中球数が1,000/mm3未満のとき、フィルグラスチム(遺伝子組換え)[後続1]400μg/m2を1日1回点滴静注する。
ただし、好中球数が5,000/mm3以上に増加した場合は、症状を観察しながら減量、あるいは投与を中止する。
小児
好中球数が1,000/mm3未満のとき、フィルグラスチム(遺伝子組換え)[後続1]400μg/m2を1日1回点滴静注する。
ただし、好中球数が5,000/mm3以上に増加した場合は、症状を観察しながら減量、あるいは投与を中止する。
なお、いずれの場合も年齢・症状により適宜増減する。
先天性・特発性好中球減少症
成人
通常、好中球数が1,000/mm3未満のとき、フィルグラスチム(遺伝子組換え)[後続1]50μg/m2を1日1回皮下投与する。
ただし、好中球数が5,000/mm3以上に増加した場合は、症状を観察しながら減量、あるいは投与を中止する。
小児
好中球数が1,000/mm3未満のとき、フィルグラスチム(遺伝子組換え)[後続1]50μg/m2を1日1回皮下投与する。
ただし、好中球数が5,000/mm3以上に増加した場合は、症状を観察しながら減量、あるいは投与を中止する。
なお、いずれの場合も年齢・症状により適宜増減する。