作成又は改訂年月
日本標準商品分類番号
薬効分類名
承認等
販売名
シロスタゾールOD錠50mg「日医工」
販売名コード
承認・許可番号
22800AMX00261000
Cilostazol OD
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法
室温保存(「取扱い上の注意」の項参照)
使用期限
外箱等に表示の使用期限内に使用すること
組成
シロスタゾールOD錠50mg「日医工」
1錠中シロスタゾール50mgを含有する。
添加物としてD-マンニトール,トウモロコシデンプン,メタケイ酸アルミン酸マグネシウム,軽質無水ケイ酸,クロスポビドン,ヒドロキシプロピルセルロース,ステアリン酸,ステアリン酸マグネシウム,アスパルテーム(L-フェニルアラニン化合物)を含有する。
製剤の性状
| 表面 | 裏面 | 側面 | 質量
(mg) | 直径
(mm) | 厚さ
(mm) | 本体表示 | 包装
コード |
 |  |  | 125 | 7.1 | 2.8 | シロスタゾール
OD
50
日医工 |  985 985 |
販売名
シロスタゾールOD錠100mg「日医工」
販売名コード
承認・許可番号
22800AMX00262000
Cilostazol OD
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法
室温保存(「取扱い上の注意」の項参照)
使用期限
外箱等に表示の使用期限内に使用すること
組成
シロスタゾールOD錠100mg「日医工」
1錠中シロスタゾール100mgを含有する。
添加物としてD-マンニトール,トウモロコシデンプン,メタケイ酸アルミン酸マグネシウム,軽質無水ケイ酸,クロスポビドン,ヒドロキシプロピルセルロース,ステアリン酸,ステアリン酸マグネシウム,アスパルテーム(L-フェニルアラニン化合物)を含有する。
製剤の性状
| 表面 | 裏面 | 側面 | 質量
(mg) | 直径
(mm) | 厚さ
(mm) | 本体表示 | 包装
コード |
 |  |  | 250 | 9.1 | 3.5 | シロスタゾール
OD
100
日医工 |  986 986 |
一般的名称
警告
本剤の投与により脈拍数が増加し,狭心症が発現することがあるので,狭心症の症状(胸痛等)に対する問診を注意深く行うこと。[他社が実施した脳梗塞再発抑制効果を検討する試験において,長期にわたりPRP(pressure rate product)を有意に上昇させる作用が認められた。また,シロスタゾール投与群に狭心症を発現した症例がみられた。](「慎重投与4.」の項,「重要な基本的注意3.」の項,「副作用 重大な副作用1. うっ血性心不全,心筋梗塞,狭心症,心室頻拍」の項参照)
禁忌
出血している患者(血友病,毛細血管脆弱症,頭蓋内出血,消化管出血,尿路出血,喀血,硝子体出血等)[出血を助長するおそれがある。]
うっ血性心不全の患者[症状を悪化させるおそれがある。](「重要な基本的注意4.」の項参照)
本剤の成分に対し過敏症の既往歴のある患者
妊婦又は妊娠している可能性のある婦人(「妊婦,産婦,授乳婦等への投与」の項参照)
効能又は効果
効能又は効果に関連する使用上の注意
無症候性脳梗塞における本剤の脳梗塞発作の抑制効果は検討されていない。
慢性動脈閉塞症に基づく潰瘍,疼痛及び冷感等の虚血性諸症状の改善
脳梗塞(心原性脳塞栓症を除く)発症後の再発抑制
用法及び用量
通常,成人には,シロスタゾールとして1回100mgを1日2回経口投与する。なお,年齢・症状により適宜増減する。
使用上の注意
慎重投与
抗凝固剤(ワルファリン等),血小板凝集を抑制する薬剤(アスピリン,チクロピジン塩酸塩,クロピドグレル硫酸塩等),血栓溶解剤(ウロキナーゼ,アルテプラーゼ等),プロスタグランジンE1製剤及びその誘導体(アルプロスタジル,リマプロスト アルファデクス等)を投与中の患者(「相互作用」の項参照)
月経期間中の患者[出血を助長するおそれがある。]
出血傾向並びにその素因のある患者[出血した時,それを助長するおそれがある。]
冠動脈狭窄を合併する患者[本剤投与による脈拍数増加により狭心症を誘発する可能性がある。](「警告」の項,「重要な基本的注意3.」の項,「副作用 重大な副作用1. うっ血性心不全,心筋梗塞,狭心症,心室頻拍」の項参照)
糖尿病あるいは耐糖能異常を有する患者[出血性有害事象が発現しやすい。]
重篤な肝障害のある患者[シロスタゾールの血中濃度が上昇するおそれがある。]
腎障害のある患者[腎機能が悪化するおそれがある。また,シロスタゾールの代謝物の血中濃度が上昇するおそれがある。(「副作用 重大な副作用7.急性腎不全」の項参照)]
持続して血圧が上昇している高血圧の患者(悪性高血圧等)(「その他の注意2.」の項参照)
重要な基本的注意
本剤の脳梗塞患者に対する投与は脳梗塞の症状が安定してから開始すること。
脳梗塞患者への投与にあたっては,他の血小板凝集を抑制する薬剤等との相互作用に注意するとともに,高血圧が持続する患者への投与は慎重に行い,投与中は十分な血圧のコントロールを行うこと。(「慎重投与1.」の項及び「相互作用」の項参照)
冠動脈狭窄を合併する患者で,本剤を投与中に過度の脈拍数増加があらわれた場合には,狭心症を誘発する可能性があるので,このような場合には減量又は中止するなどの適切な処置を行うこと。(「警告」の項,「慎重投与4.」の項,「副作用 重大な副作用1. うっ血性心不全,心筋梗塞,狭心症,心室頻拍」の項参照)
本剤はPDE3阻害作用を有する薬剤である。海外においてPDE3阻害作用を有する薬剤(ミルリノン,ベスナリノン)に関しては,うっ血性心不全(NYHA分類III〜IV)患者を対象にしたプラセボ対照長期比較試験において,生存率がプラセボより低かったとの報告がある。また,うっ血性心不全を有しない患者において,本剤を含むPDE3阻害剤を長期投与した場合の予後は明らかではない。
本剤は口腔内で崩壊するが,口腔粘膜から吸収されることはないため,唾液又は水で飲み込むこと。(「適用上の注意」の項参照)
相互作用
本剤は,主として肝代謝酵素CYP3A4及び一部CYP2D6,CYP2C19で代謝される。
併用注意
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
抗凝固剤
ワルファリン等
血小板凝集を抑制する薬剤
アスピリン,
チクロピジン塩酸塩,
クロピドグレル硫酸塩等
血栓溶解剤
ウロキナーゼ,
アルテプラーゼ等
プロスタグランジンE1製剤及びその誘導体
アルプロスタジル,
リマプロスト アルファデクス等 | 出血した時,それを助長するおそれがある。併用時には出血等の副作用を予知するため,血液凝固能検査等を十分に行う。 | 本剤は血小板凝集抑制作用を有するため,これら薬剤と併用すると出血を助長するおそれがある。 |
薬物代謝酵素(CYP3A4)を阻害する薬剤
マクロライド系抗生物質(エリスロマイシン等)
HIVプロテアーゼ阻害剤(リトナビル等)
アゾール系抗真菌剤(イトラコナゾール,ミコナゾール等)
シメチジン,
ジルチアゼム塩酸塩等
グレープフルーツジュース | 本剤の作用が増強するおそれがある。併用する場合は減量あるいは低用量から開始するなど注意すること。
また,グレープフルーツジュースとの同時服用をしないように注意すること。 | これらの薬剤あるいはグレープフルーツジュースの成分がCYP3A4を阻害することにより,本剤の血中濃度が上昇することがある。 |
薬物代謝酵素(CYP2C19)を阻害する薬剤
オメプラゾール等 | 本剤の作用が増強するおそれがある。併用する場合は減量あるいは低用量から開始するなど注意すること。 | これらの薬剤がCYP2C19を阻害することにより,本剤の血中濃度が上昇することがある。 |
副作用
副作用等発現状況の概要
本剤は使用成績調査等の副作用発現頻度が明確となる調査を実施していない。
重大な副作用
うっ血性心不全,心筋梗塞,狭心症,心室頻拍(頻度不明)
うっ血性心不全,心筋梗塞,狭心症,心室頻拍があらわれることがあるので,異常が認められた場合には投与を中止し,適切な処置を行うこと。
出血(頻度不明)
<脳出血等の頭蓋内出血>
脳出血等の頭蓋内出血(初期症状:頭痛,悪心・嘔吐,意識障害,片麻痺等)があらわれることがある。このような場合には投与を中止し,適切な処置を行うこと。
<肺出血,消化管出血,鼻出血,眼底出血等>
肺出血,消化管出血,鼻出血,眼底出血等があらわれることがある。このような場合には投与を中止し,適切な処置を行うこと。
胃・十二指腸潰瘍(頻度不明)
出血を伴う胃・十二指腸潰瘍があらわれることがあるので,観察を十分に行い,異常が認められた場合には投与を中止し,適切な処置を行うこと。
汎血球減少,無顆粒球症,血小板減少(頻度不明)
汎血球減少,無顆粒球症,血小板減少があらわれることがあるので,観察を十分に行い,異常が認められた場合には投与を中止し,適切な処置を行うこと。
間質性肺炎(頻度不明)
発熱,咳嗽,呼吸困難,胸部X線異常,好酸球増多を伴う間質性肺炎があらわれることがある。このような場合には投与を中止し,副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
肝機能障害,黄疸(頻度不明)
AST(GOT),ALT(GPT),Al-P,LDH等の上昇や黄疸があらわれることがあるので,観察を十分に行い,異常が認められた場合には投与を中止し,適切な処置を行うこと。
急性腎不全(頻度不明)
急性腎不全があらわれることがあるので,腎機能検査を行うなど観察を十分に行い,異常が認められた場合には投与を中止し,適切な処置を行うこと。
その他の副作用
| | 頻度不明 |
| 過敏症注1) | 発疹,皮疹,そう痒感,蕁麻疹,光線過敏症,紅斑等 |
| 循環器注2) | 動悸,頻脈,ほてり,血圧上昇,血圧低下,心房細動・上室性頻拍・上室性期外収縮・心室性期外収縮等の不整脈等 |
| 精神神経系注2) | 頭痛・頭重感,めまい,不眠,しびれ感,眠気,振戦,肩こり,失神・一過性の意識消失等 |
| 消化器 | 腹痛,悪心・嘔吐,食欲不振,下痢,胸やけ,腹部膨満感,味覚異常,口渇等 |
| 血液 | 貧血,白血球減少,好酸球増多等 |
| 出血傾向 | 皮下出血,血尿等 |
| 肝臓 | AST(GOT)・ALT(GPT)・Al-P・LDHの上昇等 |
| 腎臓 | BUN上昇,クレアチニン上昇,尿酸値上昇,頻尿,排尿障害等 |
| その他 | 発汗,浮腫,胸痛,血糖上昇,耳鳴,倦怠感,結膜炎,発熱,脱毛,疼痛,筋痛,脱力感 |
注1)このような場合には投与を中止すること。
注2)このような場合には減量又は投与を中止するなど適切な処置を行うこと。
高齢者への投与
一般に高齢者では生理機能が低下しているので,減量するなど注意すること。
妊婦,産婦,授乳婦等への投与
妊婦又は妊娠している可能性のある婦人には投与しないこと。[動物実験(ラット)で異常胎児の増加並びに出生児の低体重及び死亡児の増加が報告されている。]
授乳中の婦人には本剤投与中は授乳を避けさせること。[動物実験(ラット)で乳汁中への移行が報告されている。]
小児等への投与
低出生体重児,新生児,乳児,幼児又は小児に対する安全性は確立していない。(使用経験が少ない。)
適用上の注意
薬剤交付時
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。(PTPシートの誤飲により,硬い鋭角部が食道粘膜へ刺入し,更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することが報告されている。)
服用時
本剤を水なしで服用する場合には,舌の上で唾液を浸潤させ,唾液とともに飲み込むこと。
本剤は寝たままの状態で服用しないこと。
その他の注意
イヌを用いた13週間経口投与毒性試験及び52週間経口投与毒性試験において,高用量で左心室心内膜の肥厚及び冠状動脈病変が認められ,無毒性量はそれぞれ30mg/kg/day,12mg/kg/dayであった。ラット及びサルでは心臓の変化は認められなかった。1週間静脈内投与心臓毒性試験では,イヌに左心室心内膜,右心房心外膜及び冠状動脈の変化がみられ,サルでは軽度の左心室心内膜の出血性変化が認められた。他のPDE阻害剤や血管拡張剤においても動物に心臓毒性が認められており,特にイヌは発現しやすい動物種であると報告されている。
遺伝的に著しく高い血圧が持続し脳卒中が発症するとされているSHR-SP(脳卒中易発症高血圧自然発症ラット)において,シロスタゾール0.3%混餌投与群は対照群に比較して生存期間の短縮が認められた(平均寿命:シロスタゾール群40.2週,対照群43.5週)。
他社が実施した脳梗塞再発抑制効果を検討する試験において,シロスタゾール群に糖尿病の発症例及び悪化例が多くみられた。
シロスタゾール100mgとHMG-CoA還元酵素阻害薬ロバスタチン(国内未承認)80mgを併用投与したところ,ロバスタチン単独投与に比べてロバスタチンのAUCが64%増加したとの海外報告がある。
薬物動態
生物学的同等性試験
シロスタゾールOD錠50mg「日医工」
シロスタゾールOD錠50mg「日医工」は,「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン(平成24年2月29日 薬食審査発0229第10号)」に基づき,シロスタゾールOD錠100mg「日医工」を標準製剤としたとき,溶出挙動が等しく,生物学的に同等とみなされた。1)
シロスタゾールOD錠100mg「日医工」
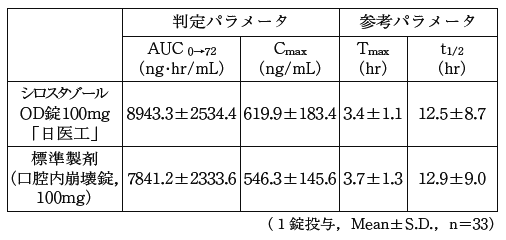
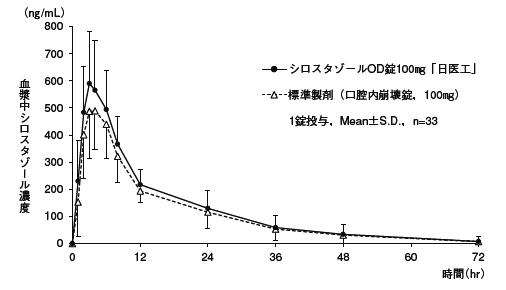
シロスタゾールOD錠100mg「日医工」及び標準製剤を,クロスオーバー法によりそれぞれ1錠(シロスタゾールとして100mg)健康成人男性に絶食単回経口投与(水なしで服用(n=33)及び水で服用(n=51))して血漿中シロスタゾール濃度を測定し,得られた薬物動態パラメータ(AUC,Cmax)について90%信頼区間法にて統計解析を行った結果,log(0.80)〜log(1.25)の範囲内であり,両剤の生物学的同等性が確認された。1)
<水なし>
<水あり>
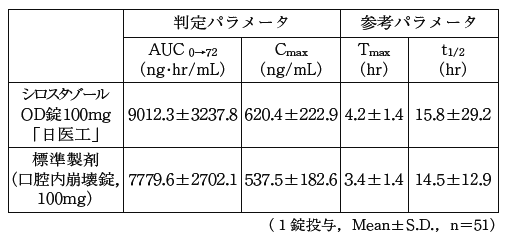
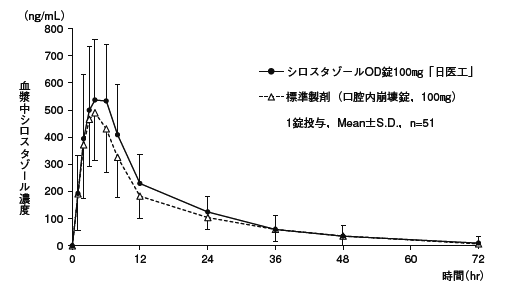
血漿中濃度並びに AUC,Cmax等のパラメータは,被験者の選択,体液の採取回数・時間等の試験条件によって異なる可能性がある。
薬効薬理
サイクリックAMP(cAMP)ホスホジエステラーゼIII(PDE III)阻害薬であり,細胞内cAMPを増加させる。血小板でcAMPが上昇すると血小板凝集が抑制され,末梢血管平滑筋でのcAMP増加は血管拡張をもたらす。これらの作用が臨床的に利用され,慢性動脈閉塞症などに用いられる。2)
有効成分に関する理化学的知見
一般名
シロスタゾール(Cilostazol)
化学名
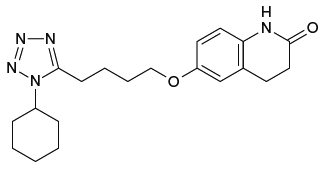
6-[4-(1-Cyclohexyl-1H-tetrazol-5-yl)butyloxy]-3,4-dihydroquinolin-2(1H)-one
構造式
分子式
C20H27N5O2
分子量
369.46
性状
白色〜微黄白色の結晶又は結晶性の粉末である。
メタノール,エタノール(99.5)又はアセトニトリルに溶けにくく,水にほとんど溶けない。
融点
158〜162℃
取扱い上の注意
本剤は,口腔内崩壊錠のため自動分包機を使用する場合は欠けることがあるので,カセットの位置及び錠剤投入量などに配慮すること。
保管方法
PTP包装品
アルミピロー開封後は湿気を避けて保存すること。
プラスチックボトル包装品
湿度の影響を受けやすいので,使用の都度キャップをしっかり締めること
安定性試験
本品につき加速試験(40℃,相対湿度75%,6ヵ月)を行った結果,シロスタゾールOD錠50mg「日医工」及びシロスタゾールOD錠100mg「日医工」は通常の市場流通下において3年間安定であることが推測された。3)
包装
シロスタゾールOD錠50mg「日医工」
100錠(10錠×10;PTP)
シロスタゾールOD錠100mg「日医工」
100錠(10錠×10;PTP)
主要文献及び文献請求先
主要文献
1
日医工株式会社 社内資料:生物学的同等性試験
2
第十六改正日本薬局方解説書 C-2097,廣川書店,東京(2011)
3
日医工株式会社 社内資料:安定性試験
文献請求先
主要文献欄に記載の文献・社内資料は下記にご請求下さい。
日医工株式会社 お客様サポートセンター
〒930‐8583 富山市総曲輪1丁目6番21
フリーダイアル(0120)517-215
Fax(076)442-8948
製造販売業者等の氏名又は名称及び住所
製造販売元
日医工株式会社
富山市総曲輪1丁目6番21


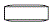
 985
985

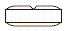
 986
986