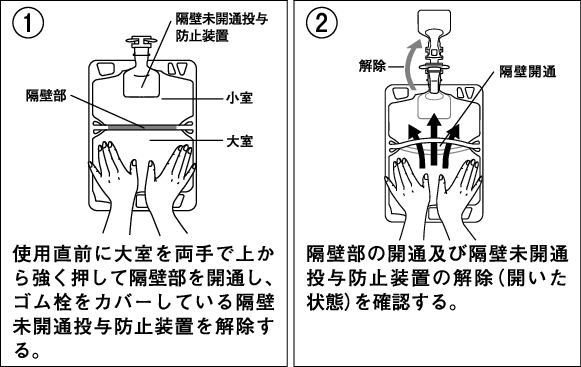
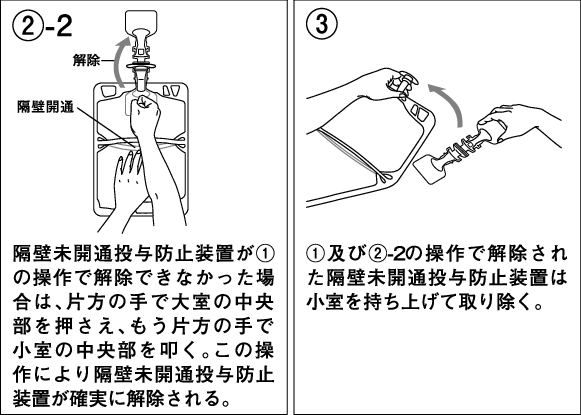
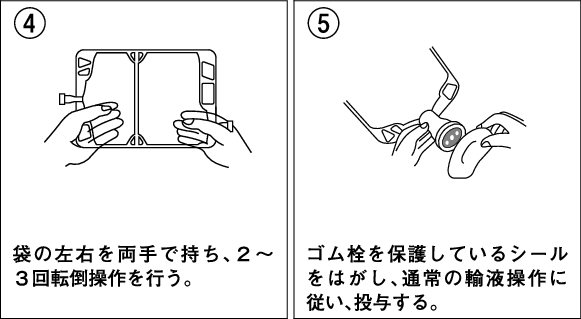
1
長谷部正晴, 他:日本臨床栄養学会雑誌. 2006;27(4):380-412
2
社内資料:正常ビーグル犬におけるTAJ-01投与時の血中ビタミンB1濃度の推移(2006年3月3日承認、申請資料概要 ホ.1)
アミノ酸・ビタミンB1加総合電解質液
1キット 526円
有効成分 | ブドウ糖 37.499g |
|---|
有効成分 | 塩化ナトリウム 0.399g |
|---|---|
有効成分 | L-乳酸ナトリウム液 2.290g L-乳酸ナトリウムとして 1.145g |
有効成分 | グルコン酸カルシウム水和物 0.560g |
有効成分 | 硫酸マグネシウム水和物 0.312g |
有効成分 | 硫酸亜鉛水和物 0.700mg |
有効成分 | チアミン塩化物塩酸塩 1.000mg |
|---|
添加剤 | 氷酢酸(pH調節剤) 適量 |
|---|
有効成分 | L-ロイシン 2.100g |
|---|---|
有効成分 | L-イソロイシン 1.200g |
有効成分 | L-バリン 1.200g |
有効成分 | L-リシン塩酸塩 1.965g L-リシンとして 1.573g |
有効成分 | L-トレオニン 0.855g |
有効成分 | L-トリプトファン 0.300g |
有効成分 | L-メチオニン 0.585g |
有効成分 | L-フェニルアラニン 1.050g |
有効成分 | L-システイン 0.150g |
有効成分 | L-チロシン 0.075g |
有効成分 | L-アルギニン 1.575g |
有効成分 | L-ヒスチジン 0.750g |
有効成分 | L-アラニン 1.200g |
有効成分 | L-プロリン 0.750g |
有効成分 | L-セリン 0.450g |
有効成分 | グリシン 0.885g |
有効成分 | L-アスパラギン酸 0.150g |
有効成分 | L-グルタミン酸 0.150g |
有効成分 | リン酸二カリウム 0.870g |
|---|
添加剤 | 亜硫酸水素ナトリウム(安定剤) 7.5mg 氷酢酸(pH調節剤) 適量 |
|---|
| 糖 | ブドウ糖 37.499g | ブドウ糖濃度 7.5% | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 電解質 | Na+注) 17.1mEq | K+ 10mEq | Mg2+ 2.5mEq | Ca2+ 2.5mEq | Cl- 17.6mEq | SO42- 2.5mEq | Acetate-注) 9.5mEq | Gluconate- 2.5mEq | Lactate- 10mEq | P 5mmol | Zn 2.4μmol |
| ビタミン | チアミン塩化物塩酸塩 1.000mg | ||||||||||
| アミノ酸 | 総遊離アミノ酸量 15.00g | 総窒素量 2.35g | 分岐鎖アミノ酸含有率 30w/w% | 必須アミノ酸/非必須アミノ酸 1.79 | |||||||
| 総カロリー量 | 210kcal | ||||||||||
| 非蛋白カロリー量 | 150kcal | ||||||||||
| 非蛋白カロリー/N | 64 |
| 大室液 | |
| pH | 4.2~5.2 |
|---|---|
| 浸透圧比 | 約3(生理食塩液に対する比) |
| 性状 | 無色澄明の液 |
| 小室液 | |
| pH | 6.7~7.7 |
|---|---|
| 浸透圧比 | 約3(生理食塩液に対する比) |
| 性状 | 無色澄明の液 |
| 混合液 | |
| pH | 約6.7 |
|---|---|
| 浸透圧比 | 約3(生理食塩液に対する比) |
| 性状 | 無色澄明の液 |
5%以上 | 0.1~5%未満 | 頻度不明 | |
|---|---|---|---|
過敏症 | 発疹等 | ||
肝臓 | γ-GTP増加 | 肝機能異常、AST増加、ALT増加、Al-P増加 | |
代謝異常 | 血中トリグリセリド増加 | ||
循環器 | 胸部不快感、動悸 | ||
電解質異常 | 血中カリウム増加 | ||
大量・急速投与 | アシドーシス、脳浮腫、肺水腫、末梢の浮腫、高カリウム血症、水中毒 | ||
その他 | 血管痛、静脈炎、注入部位紅斑、注入部位疼痛、注入部位腫脹 | 注入部位硬結、血管炎 | 悪寒、発熱、熱感、頭痛 |