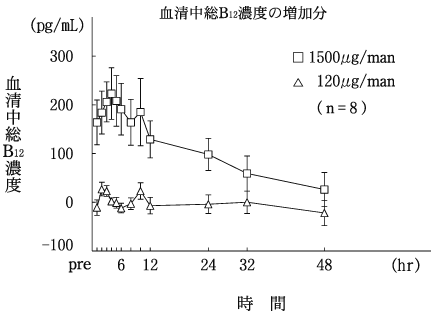
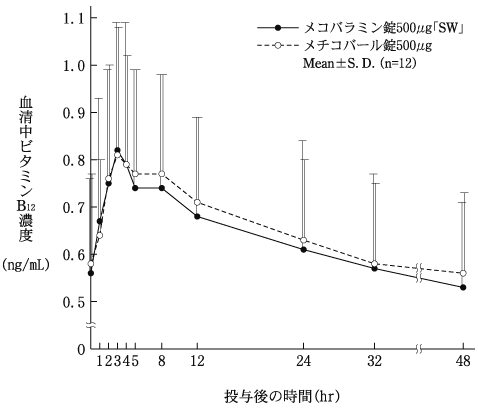
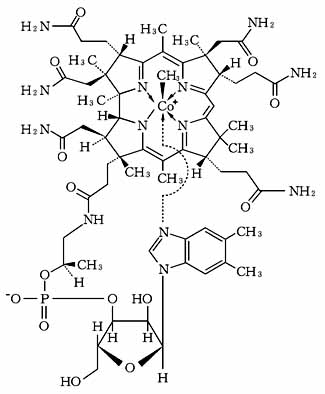
1
田中信夫他:新薬と臨牀, 1986;35(1):67-74
2
田中信夫他:ビタミン, 1981;55(3):155-161
3
第十八改正日本薬局方解説書, 廣川書店, 2021;C-5618-5623
4
社内資料:生物学的同等性試験
5
亀山正邦他:臨床評価, 1972;1(1):71-76
6
亀山正邦他:臨牀と研究, 1972;49(7):1963-1966
7
稲田雅美他:神経系とメチルB12(協和企画通信), 1981:23-29
8
中沢恒幸他:ビタミン, 1970;42(3):193-197
9
中沢恒幸他:ビタミン, 1970;42(5):275-279
10
髙折修二他監訳:グッドマン・ギルマン薬理書, 第12版, 廣川書店, 2013;1394-1396
11
竹中敏文他:Prog. Med., 1982;2(10):1759-1762
12
大西晃生他:臨床薬理, 1987;18(2):387-392
13
Watanabe, T. et al.:J. Neurol. Sci., 1994;122(2):140-143
14
斉藤豊和他:神経系とメチルB12(協和企画通信), 1981:75-86
15
Yamazaki, K. et al.:Neurosci. Lett., 1994;170(1):195-197
16
八木橋操六他:臨床薬理, 1988;19(2):437-443
17
中沢恒幸他:神経系とメチルB12(協和企画通信), 1981:54-60
18
米沢猛他:神経系とメチルB12(協和企画通信), 1981:49-53
19
渋谷統寿:神経系とメチルB12(協和企画通信), 1981:134-140
20
Sasaki, H. et al.:Pharmacol. Biochem. Behav., 1992;43(2):635-639