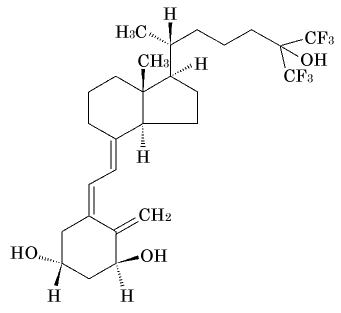
1
揖場和子: 透析と腎性骨異栄養症. 中外医学社. 1994; 176-192[33532]
2
井上聖士ほか: 透析患者の骨病変-その見方と考え方-. 日本メディカルセンター. 1988; 249-258[33533]
3
Velentzas C., et al.: Can. Med. Assoc. J. 1978; 118: 45-50[33534]
4
角尾道夫: 臨床医薬. 1997; 13: 1907-1919[33425]
5
赤尾恭子ほか: 基礎と臨床. 1996; 30: 2945-2953[33449]
6
小室勢津子ほか: 薬物動態. 1996; 11: 505-517[33448]
7
小室勢津子ほか: 薬物動態. 1996; 11: 530-540[33447]
8
小室勢津子ほか: 基礎と臨床. 1996; 30: 2915-2932[33451]
9
小室勢津子ほか: 薬物動態. 1996; 11: 518-529[33434]
10
浅野泰ほか: 臨床医薬. 1997; 13: 2559-2571[33424]
11
森井浩世ほか: 腎と透析. 1997; 42: 697-721[33421]
12
森井浩世ほか: 日本透析医学会誌. 1997; 30: 895-910[33423]
13
森井浩世ほか: 腎と透析. 1997; 43: 271-283[33420]
14
森井浩世ほか: J. Bone Miner. Metab. 1998; 16: 34-43[33418]
15
森井浩世ほか: J. Bone Miner. Metab. 1998; 16: 44-54[33417]
16
松本俊夫ほか: ホルモンと臨床. 1997; 45: 595-608[33429]
17
松本俊夫ほか: ホルモンと臨床. 1997; 45: 693-706[33428]
18
松本俊夫ほか: ホルモンと臨床. 1997; 45: 789-803[33422]
19
吉川靖三ほか: 診療と新薬. 1997; 34: 331-357[33431]
20
吉川靖三ほか: 診療と新薬. 1997; 34: 359-380[33430]
21
勝又隆ほか: 基礎と臨床. 1996; 30: 2955-2962[33439]
22
Harada M., et al.: Bone Miner. 1992; 18: 41-49[33518]
23
津島直美ほか: 基礎と臨床. 1996; 30: 2963-2974[33438]
24
勝又隆ほか: 基礎と臨床. 1996; 30: 2975-2982[33437]






 212
212
 213
213