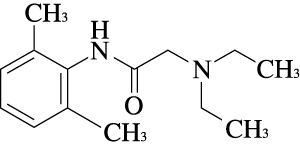
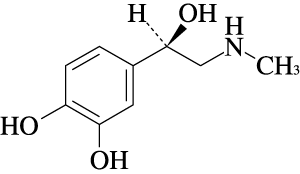
1
伊東哲ほか:日本歯科麻酔学会雑誌 1979;7(2):212-213
2
Nation, R.L., et al.:Br. J. Clin. Pharmacol.1977;(4):439-448
3
Burm, A.G.L.:Clin. Pharmacokinet.1989;16(5):283-311
4
Keenaghan, J.B., et al.:J. Pharmacol. Exp. Ther.1972;180(2):454-463
5
Thomson, P.D.:Ann. Intern. Med.1973;78(4):499-508
6
Wiedling, S.:Anaesthesist.1952;1(4):119-126
7
Wiedling, S.:Acta Pharmacol. Toxicol.1952;8:117-133
8
円谷福男:麻酔 1957;6(5):357-366
9
植木昭和ほか:福岡医学雑誌 1960;51(12):1361-1374
10
Krantz, J.C.:J. Pharmacol. Exp. Ther.1954;111:224-228
11
Truant, A.P.:Arch. Int. Pharmacodyn.1958;115(4):483-497