1
社内資料:トリニトログリセリンとの薬物相互作用の検討
2
社内資料:一硝酸イソソルビドとの薬物相互作用の検討
3
Webb DJ,et al.:Am J Cardiol.1999;83(5A):21-28
4
Webb DJ,et al.:J Am Coll Cardiol.2000;36(1):25-31
5
Morganroth J,et al.:Am J Cardiol.2004;93(11):1378-1383
6
Galie N,et al.:Eur Respir J.2015;45(5):1314-1322
7
Wilner K,et al.:Br J Clin Pharmacol.2002;53(Suppl.1):31S-36S
8
社内資料:エリスロマイシンとの薬物相互作用の検討
9
Zusman RM,et al.:Am J Cardiol.1999;83(5A):35-44
10
社内資料:リトナビルとの薬物相互作用の検討
11
Muirhead GJ,et al.:Br J Clin Pharmacol.2000;50(2):99-107
12
社内資料:アムロジピンとの薬物相互作用の検討
13
社内資料:ドキサゾシンとの薬物相互作用の検討-2試験
14
Campbell UB,et al.:JOURNAL OF SEXUAL MEDICINE.2015;12(1):139-151
15
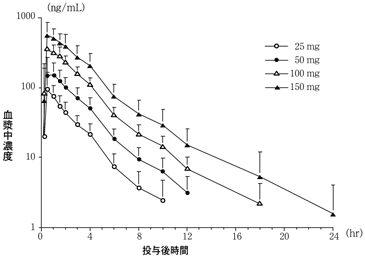
社内資料:日本人健康成人を対象とした単回投与試験―用量相関性に関する検討
16
社内資料:日本人健康成人を対象とした反復投与試験
17
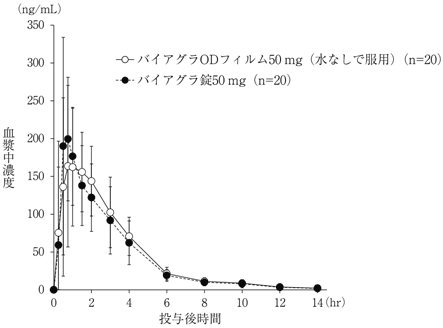
社内資料:生物学的同等性試験 1
18
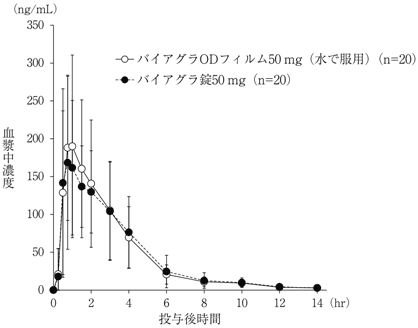
社内資料:生物学的同等性試験 2
19
社内資料:日本人健康成人を対象とした単回投与試験―食事の影響に関する検討
20
Hyland R,et al.:Br J Clin Pharmacol.2001;51(3):239-248
21
社内資料:日本人健康成人を対象とした単回投与試験
22
Muirhead GJ,et al.:Br J Clin Pharmacol.2002;53(Suppl.1):21S-30S
23
白井將文ほか:西日本泌尿器科.2000;62(6):373-382
24
Ballard SA,et al.:J Urol.1998;159(6):2164-2171
25
Jeremy JY,et al.:Br J Urol.1997;79(6):958-963
26
Carter AJ,et al.:J Urol.1998;160(1):242-246