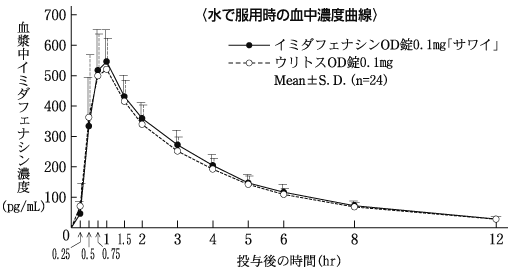
1
髙野和彦他:診療と新薬, 2020;57(4):317-322
2
田中孝典他:診療と新薬, 2020;57(4):309-316
3
Kanayama, N. et al.:Xenobiotica, 2007;37(2):139-154
4
島田英世他:臨床医薬, 2007;23(4):233-248
5
島田英世他:臨床医薬, 2007;23(4):263-272
6
Ohno, T. et al.:J. Clin. Pharmacol., 2008;48:330-334
7
Hasegawa, C. et al.:Drug Metab. Pharmacokinet., 2013;28(3):203-212
8
母集団薬物動態(PPK)解析(ウリトス錠/ステーブラ錠:2009年12月18日承認、審査報告書)
9
小林文義他:日本排尿機能学会誌, 2007;18(2):292-298