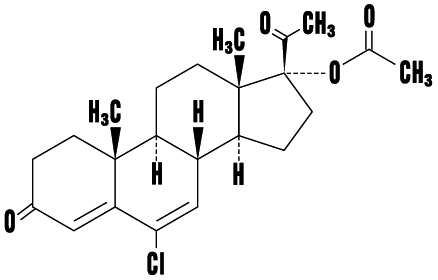
1
Pierre Nguyen, et al.:Utilisation prolongée de l’acétate de chlormadinone et risque de méningiome intracrânien:une étude de cohorte à partir des données du SNDS(Avril 2021 Rapport final)
2
木下裕三他:薬理と治療.1988;16(5):2079-2091
3
木下裕三他:薬理と治療.1988;16(5):2093-2108
4
神戸川 明他:基礎と臨床.1977;11(2):620-628
5
社内資料:Chlormadinone acetateの肝薬物代謝酵素活性に及ぼす影響と蛋白結合性の検討
6
Honma,S.et al.:Chem.Pharm.Bull.1977;25(8):2019-2031
7
志田圭三他:臨床医薬.1988;4(7):1145-1164
8
吉田和弘他:診療と新薬.1988;25(6):1239-1251
9
薄井昭博他:診療と新薬.1988;25(5):923-930
10
池本 庸他:臨床医薬.1988;4(9):1723-1729
11
三枝 衛他:基礎と臨床.1977;11(2):550-555
12
伊藤善一他:日本泌尿器科学会雑誌.1977;68(6):537-552
13
山中英寿他:ホルモンと臨床.1978;26(1):89-92