1
厚生労働省:重篤副作用疾患別対応マニュアル 薬剤性過敏症症候群
2
奥野晃正 他:日本小児科学会雑誌 1982;86(4):578-581
3
第十七改正日本薬局方解説書(廣川書店) C-3044, C-4836
4
Richards,J. B. et al.:Endocrinol. 1959;65:198-207
5
塩川喜之 他:日本内分泌学会雑誌 1964;40(1):34-48
抗甲状腺剤
1錠 9.8円
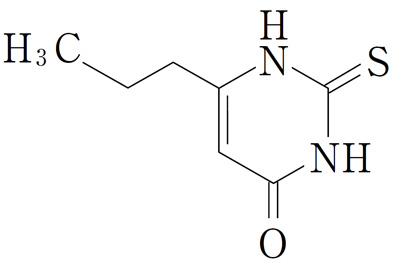
有効成分 | 1錠中 日局 プロピルチオウラシル 50mg |
|---|---|
添加剤 | ヒドロキシプロピルセルロース、カルメロースカルシウム、ステアリン酸マグネシウム、乳糖水和物、グリセリン脂肪酸エステル、ステアリン酸、酸化チタン |
| 外形 |  |
|---|---|
| 大きさ | 大きさ(直径) 7.2mm 大きさ(厚さ) 約3.5mm |
| 質量 | 115mg |
| 識別コード | TT252 |
| 性状・剤形 | 白色・フィルムコーティング錠 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
クマリン系抗凝血剤 ワルファリンカリウム | 併用開始時、中止時及び病態の変化に応じて血液凝固能が変化するので、血液凝固能検査値の変動に十分注意し、必要があれば抗凝血剤の用量調節を行う。 | 甲状腺機能が亢進すると凝固因子の合成・代謝亢進により、相対的にクマリン系抗凝血剤の効果は増強する。本剤投与により甲状腺機能が正常化すると、増強されていたクマリン系抗凝血剤の効果が減弱するとの報告がある。 |
ジギタリス製剤 ジゴキシン等 | 併用開始時、中止時及び病態の変化に応じてジギタリス製剤の血中濃度が変動するので、血中濃度の変動に十分注意し、必要があればジギタリス製剤の用量調節を行う。 | 甲状腺機能亢進時には、代謝・排泄が促進されているため、ジギタリス製剤の血中濃度が正常時に比較して低下する。本剤投与により甲状腺機能が正常化すると、ジギタリス製剤の血中濃度が上昇するとの報告がある。 |
頻度不明 | |
|---|---|
肝臓 | AST上昇、ALT上昇 |
皮膚 | 脱毛、色素沈着、瘙痒感、紅斑 |
消化器 | 悪心・嘔吐、下痢、食欲不振 |
精神神経系 | 頭痛、めまい、末梢神経異常 |
過敏症注) | 発疹、蕁麻疹、発熱 |
その他 | CK上昇、こむらがえり、筋肉痛、倦怠感、リンパ節腫脹、関節痛、唾液腺肥大、浮腫、味覚異常(苦味、味覚減退) |