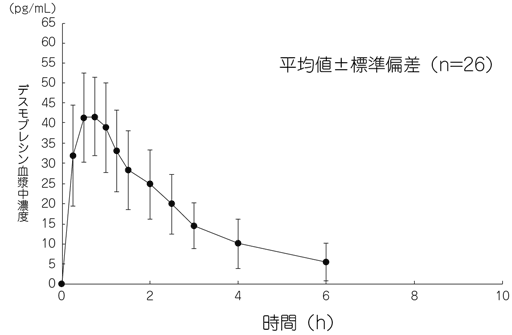
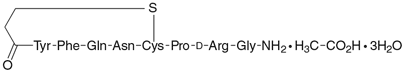1
赤司俊二.:小児科. 1994; 35: 263-272. [文献請求番号][FP00494]
2
赤司俊二.:小児科診療. 1990; 53: 722-725. [文献請求番号][FP00495]
3
社内資料:KW-8008 RTS スプレーとKW-8008スプレーの生物学的同等性試験(2010年12月22日承認 ホ-3). [文献請求番号][FP10829]
4
西垣淳子 他.:基礎と臨床. 1995; 29: 2517-2539. [文献請求番号][FP00484]
5
西垣淳子 他.:基礎と臨床. 1995; 29: 2553-2560. [文献請求番号][FP00485]
6
社内資料:125I-KW-8008のin vitro蛋白結合. [文献請求番号][FP03766]
7
清水倉一 他.:最新医学. 1978; 33: 1875-1882. [文献請求番号][FP00465]
8
帆足英一 他.:小児科臨床. 2003; 56: 965-982. [文献請求番号][FP00503]
9
社内資料:バソプレシンV2受容体に対する結合親和性(2003年1月31日承認、申請資料概要ホ-I-2、1)) [文献請求番号][FP03767]
10
社内資料:水及び尿素透過性亢進作用(2003年1月31日承認、申請資料概要ホ-I-2、2)). [文献請求番号][FP09948]
11
社内資料:尿排泄量に対する作用(2003年1月31日承認、申請資料概要ホ-I-1、1)). [文献請求番号][FP09949]