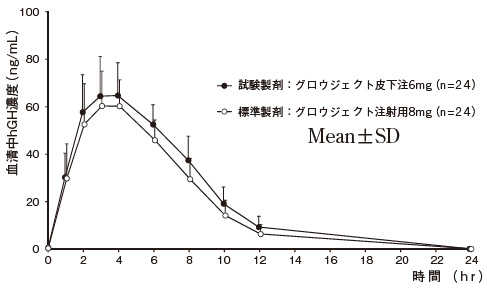
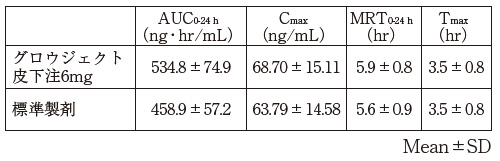
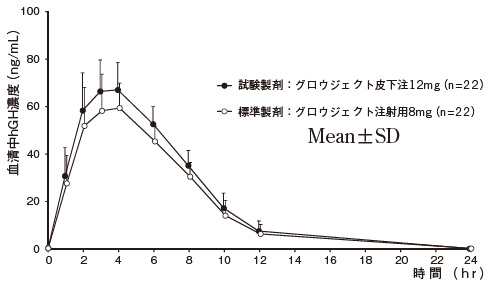
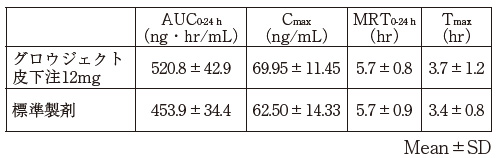
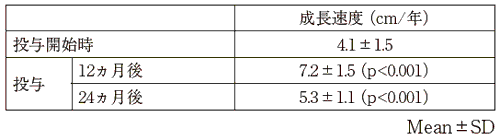
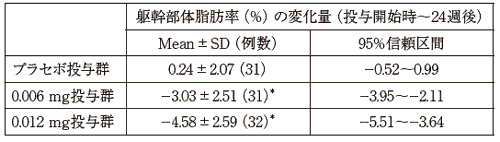
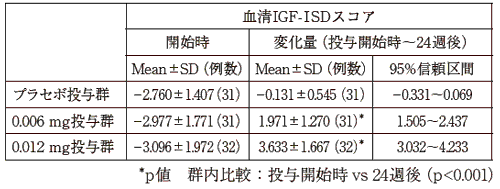
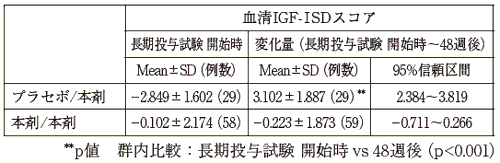
1
Gustafsson, J.:Acta Pediatr. Scand.[Suppl.]362, 50, 1989
2
Randall, R. V.:Acromegaly and Gigantism, Chapter 26:Endocrinology, Vol. 1, 1989, W. B. Saunders Company
3
渡瀬貴博 他:基礎と臨床, 27(15 Nov), 5733, 1993
4
社内資料:JR-401(液状製剤)における生物学的同等性試験
5
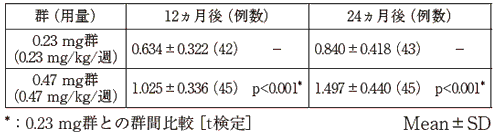
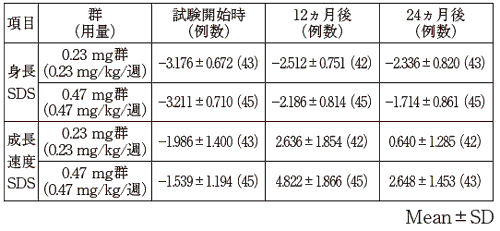
田中敏章 他:新薬と臨床, 47(8), 1251, 1998
6
田中敏章 他:薬理と治療, 27(12), 1857, 1999
7
社内資料:成人成長ホルモン分泌不全症(AGHD)に対するJR-401のプラセボ対照二重盲検群間比較試験
8
社内資料:成人成長ホルモン分泌不全症(AGHD)に対するJR-401の長期投与試験
9
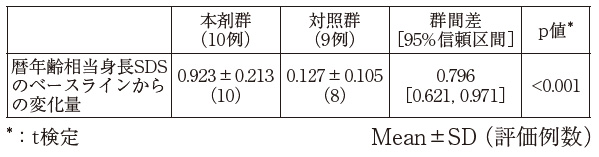
社内資料:SGA性低身長症に対するJR-401の臨床試験
10
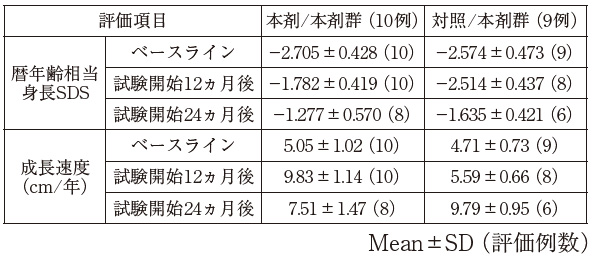
社内資料:SHOX異常症における低身長に対するJR-401の臨床試験
11
田中敏章 他:基礎と臨床, 26(1 Jan), 443, 1992
12
野崎 修 他:基礎と臨床, 25(12 Sep), 3672, 1991
13
河野誠一 他:基礎と臨床, 25(12 Sep), 3683, 1991
14
社内資料:下垂体摘出成熟ラットの体組成および脂質代謝異常に対するJR-401の効果
15
野村啓一 他:基礎と臨床, 25(12 Sep), 3599, 1991