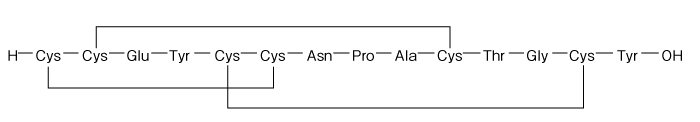
1
社内報告書:マウス・生殖発生毒性試験(2016年12月19日承認 CTD 2.6.6.6、CTD 2.6.7.12~CTD 2.6.7.14)(DIR160112)
2
Cohen, M. B. et al.:Gastroenterology 1988;94(2):367-373[R-07344]
3
社内報告書:マウス・幼若毒性試験(2016年12月19日承認 CTD 2.6.6.6.6、CTD 2.6.7.15)(DIR160113)
4
社内報告書:健康成人・第Ⅰ相単回投与試験(2016年12月19日承認 CTD 2.7.6.2)(DIR160072)
5
社内報告書:健康成人・第Ⅰ相反復投与試験(2016年12月19日承認 CTD 2.7.6.3)(DIR160073)
6
社内報告書:便秘型過敏性腸症候群患者・第Ⅱ相試験(2016年12月19日承認 CTD 2.7.6.6)(DIR160078)
7
社内報告書:ヒト腸液中安定性・薬物動態(2016年12月19日承認 CTD 2.7.2.2.1.2)(DIR160104)
8
社内報告書:ヒト小腸ミクロソーム中安定性・薬物動態(2016年12月19日承認 CTD 2.7.2.2.1.3)(DIR160092)
9
社内報告書:ヒト肝臓CYP阻害・薬物動態(2016年12月19日承認 CTD 2.6.4.5.2.3)(DIR160093)
10
社内報告書:ヒト小腸CYP阻害・薬物動態(2016年12月19日承認 CTD 2.6.4.5.2.2)(DIR160094)
11
社内報告書:ヒト肝臓CYP誘導・薬物動態(2016年12月19日承認 CTD 2.6.4.5.2.1)(DIR160095)
12
社内報告書:ヒトP-gp基質・阻害・薬物動態(2016年12月19日承認 CTD 2.7.2.2.1.4)(DIR160096)
13
社内報告書:ヒトトランスポーター阻害・薬物動態(2016年12月19日承認 CTD 2.7.2.2.1.5)(DIR160097)
14
社内報告書:便秘型過敏性腸症候群患者・第Ⅲ相試験(2016年12月19日承認 CTD 2.7.6.7)(DIR160071)
15
社内報告書:慢性便秘症患者・第Ⅲ相試験(2018年8月21日承認 CTD 2.7.6.2)(DIR170080)
16
社内報告書:ヒトGC-C受容体親和性・薬理作用(2016年12月19日承認 CTD 2.6.2.2.1.1~CTD 2.6.2.2.1.2)(DIR160081)
17
社内報告書:ヒトGC-C受容体刺激・薬理作用(2016年12月19日承認 CTD 2.6.2.2.3.1)(DIR160083)
18
社内報告書:マウス腸管分泌・薬理作用(2016年12月19日承認 CTD 2.6.2.2.4.1)(DIR160084)
19
社内報告書:ラット腸管分泌・薬理作用(2016年12月19日承認 CTD 2.6.2.2.4.2)(DIR160085)
20
社内報告書:マウス腸管輸送能・薬理作用(2016年12月19日承認 CTD 2.6.2.2.5.1)(DIR160086)
21
社内報告書:ラット腸管輸送能・薬理作用(2016年12月19日承認 CTD 2.6.2.2.5.2)(DIR160087)
22
社内報告書:ラットストレス誘発大腸痛覚過敏・薬理作用(2016年12月19日承認 CTD 2.6.2.2.6.2)(DIR160089)
23
社内報告書:ラット大腸炎誘発大腸痛覚過敏・薬理作用(2016年12月19日承認 CTD 2.6.2.2.6.4)(DIR160090)
24
社内報告書:マウス大腸炎誘発大腸痛覚過敏・薬理作用(2016年12月19日承認 CTD 2.6.2.2.6.5)(DIR160091)








 725
725