1
社内資料:妊娠動物および胎仔での生体内動態(ラット)(承認年月日:2013年3月25日、CTD2.6.4.6)
2
社内資料:24カ月間がん原性試験(ラット)(承認年月日:2013年3月25日、CTD2.6.6.5)
3
社内資料:24カ月間がん原性試験(マウス)(承認年月日:2013年3月25日、CTD2.6.6.5)
4
社内資料:ENU誘発子宮がんに及ぼす影響(rasH2マウス)(承認年月日:2013年3月25日、CTD2.6.6.5)
5
社内資料:第I相臨床試験(単回投与試験)(承認年月日:2013年3月25日、CTD2.7.6.1)
6
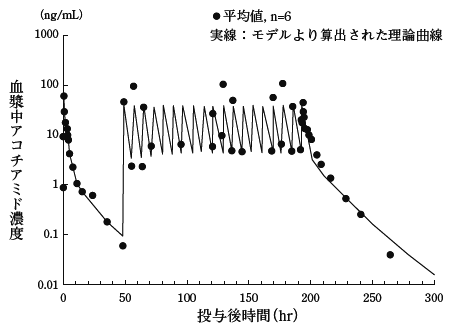
社内資料:第I相臨床試験(反復投与試験)(承認年月日:2013年3月25日、CTD2.7.6.1)
7
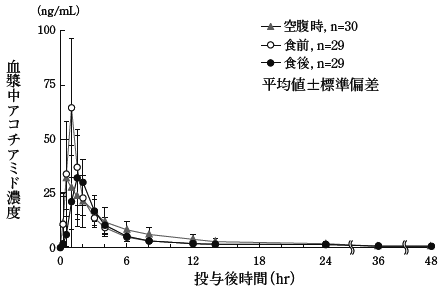
社内資料:薬物動態試験(食事の影響)(承認年月日:2013年3月25日、CTD2.7.6.4)
8
社内資料:動態試験(単回投与後の体内動態;追加)(承認年月日:2013年3月25日、CTD2.6.4.4)
9
社内資料:Mass Balance and Metabolism Study(第I相臨床試験)
10
社内資料:Metabolite Profiling of Acotiamide(Human Mass Balance Study)(承認年月日:2013年3月25日、CTD2.7.2.2)
11
Furuta S. et al.:Eur J Pharmacol. 2004;497:223-231
12
Matsueda K. et al.:Gut. 2012;61:821-828
13
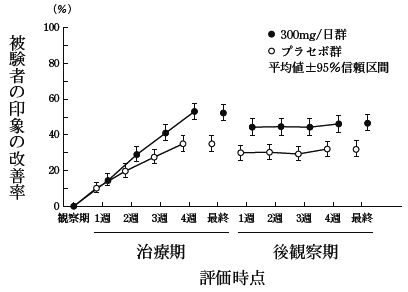
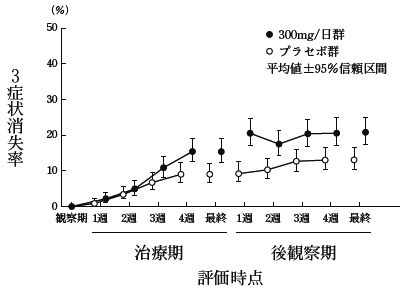
社内資料:第III相臨床試験(承認年月日:2013年3月25日、CTD2.7.6.3)
14
社内資料:長期投与試験(承認年月日:2013年3月25日、CTD2.7.6.3)
15
Matsunaga Y. et al.:J Pharmacol Exp Ther. 2011;336:791-800
16
Nagahama K. et al.:Neurogastroenterol Motil. 2012;24:566-574
17
Kawachi M. et al.:Eur J Pharmacol. 2011;666:218-225