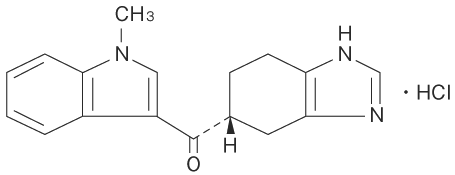
1
中島光好 他:臨床と研究 72(11):2912, 1995[NA-088]
2
中島光好 他:臨床と研究 71(9):2461, 1994[NA-065]
3
社内報告書(健康成人・薬物動態)(D199603030-02.00, 1996)
4
社内報告書(ヒト肝ミクロソーム・代謝)(DIR050011)
5
野田起一郎 他:新薬と臨床 45(3):482, 1996[NA-00288]
6
野田起一郎 他:新薬と臨床 45(7):1309, 1996[NA-110]
7
野田起一郎 他:新薬と臨床 45(8):1445, 1996[NA-116]
8
武谷雄二 他:産科と婦人科 63(9):1297, 1996[NA-093]
9
武谷雄二 他:産婦人科の世界 48(8):749, 1996[NA-117]
10
Miyata, K. et al.:J. Pharmacol. Exp. Ther. 259(1):15, 1991[NA-033]
11
Miyata, K. et al.:J. Pharmacol. Exp. Ther. 259(2):815, 1991[NA-00196]
12
藤原 明 他:薬理と臨床 6(7):1209, 1996[NA-153]
13
藤原 明:薬理と臨床 6(7):1215, 1996[NA-155]







 405
405