作成又は改訂年月
**印:
2020年1月改訂
(第19版)
*印:
2016年10月改訂
日本標準商品分類番号
日本標準商品分類番号等
2004年 9月2009年12月
薬効分類名
承認等
販売名
ウルソデオキシコール酸錠50mg「テバ」
販売名コード
承認・許可番号
22500AMX01309000
Ursodeoxycholic acid Tab. 50mg“TEVA”
薬価収載
販売開始
使用期限等
貯 法
室温保存
使用期限
外装に表示の使用期限内に使用すること。
基準名
組成
1錠中:
ウルソデオキシコール酸…………50mg
〈添加物〉
カルメロースカルシウム、軽質無水ケイ酸、結晶セルロース、ステアリン酸マグネシウム、トウモロコシデンプン、ヒドロキシプロピルセルロース
性状
白色の素錠で、においはなく、味は苦い
識別コード(PTP)
US

外形(サイズ)
表(直径mm)

6.0
外形(サイズ)
裏(重量mg)

70
外形(サイズ)
側面(厚さmm)

2.2
販売名
ウルソデオキシコール酸錠100mg「テバ」
販売名コード
承認・許可番号
22500AMX01310000
Ursodeoxycholic acid Tab. 100mg“TEVA”
薬価収載
販売開始
使用期限等
貯 法
室温保存
使用期限
外装に表示の使用期限内に使用すること。
基準名
組成
1錠中:
ウルソデオキシコール酸…………100mg
〈添加物〉
カルメロースカルシウム、軽質無水ケイ酸、結晶セルロース、ステアリン酸マグネシウム、トウモロコシデンプン、ヒドロキシプロピルセルロース
性状
白色の片面1/2割線入り素錠で、においはなく、味は苦い
識別コード(PTP)
US

外形(サイズ)
表(直径mm)

8.0
外形(サイズ)
裏(重量mg)
140
外形(サイズ)
側面(厚さmm)

2.5
禁忌
完全胆道閉塞のある患者[利胆作用があるため、症状が増悪するおそれがある]
劇症肝炎の患者[症状が増悪するおそれがある]
効能・効果
〈効能・効果に関連する使用上の注意〉
原発性胆汁性肝硬変における肝機能の改善:
・硬変期で高度の黄疸のある患者に投与する場合は、症状が悪化するおそれがあるので慎重に投与すること。血清ビリルビン値の上昇等がみられた場合には、投与を中止するなど適切な処置を行うこと。
C型慢性肝疾患における肝機能の改善:
・C型慢性肝疾患においては、まずウイルス排除療法を考慮することが望ましい。本薬にはウイルス排除作用はなく、現時点ではC型慢性肝疾患の長期予後に対する肝機能改善の影響は明らかではないため、ウイルス排除のためのインターフェロン治療無効例若しくはインターフェロン治療が適用できない患者に対して本薬の投与を考慮すること。
・非代償性肝硬変患者に対する有効性及び安全性は確立していない。高度の黄疸のある患者に投与する場合は、症状が悪化するおそれがあるので慎重に投与すること。血清ビリルビン値の上昇等がみられた場合には、投与を中止するなど適切な処置を行うこと。
○下記疾患における利胆
胆道(胆管・胆のう)系疾患及び胆汁うっ滞を伴う肝疾患
○慢性肝疾患における肝機能の改善
○下記疾患における消化不良
小腸切除後遺症、炎症性小腸疾患
外殻石灰化を認めないコレステロール系胆石の溶解
原発性胆汁性肝硬変における肝機能の改善
C型慢性肝疾患における肝機能の改善
用法・用量
ウルソデオキシコール酸として、通常、成人1回50mgを1日3回経口投与する。なお、年齢、症状により適宜増減する。
外殻石灰化を認めないコレステロール系胆石の溶解には、ウルソデオキシコール酸として、通常、成人1日600mgを3回に分割経口投与する。なお、年齢、症状により適宜増減する。
原発性胆汁性肝硬変における肝機能の改善には、ウルソデオキシコール酸として、通常、成人1日600mgを3回に分割経口投与する。なお、年齢、症状により適宜増減する。増量する場合の1日最大投与量は900mgとする。
C型慢性肝疾患における肝機能の改善には、ウルソデオキシコール酸として、通常、成人1日600mgを3回に分割経口投与する。なお、年齢、症状により適宜増減する。増量する場合の1日最大投与量は900mgとする。
使用上の注意
慎重投与
重篤な膵疾患のある患者[原疾患が悪化するおそれがある]
消化性潰瘍のある患者[粘膜刺激作用があるため、症状が増悪するおそれがある]
胆管に胆石のある患者[利胆作用があるため、胆汁うっ滞を惹起するおそれがある]
相互作用
併用注意
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|
スルフォニル尿素系経口糖尿病用薬
トルブタミド等 | 血糖降下作用を増強するおそれがある。 | 本剤は血清アルブミンとトルブタミドとの結合を阻害するとの報告がある。 |
|---|
| コレスチラミン等 | 本剤の作用を減弱するおそれがあるので、可能な限り間隔をあけて投与すること。 | 本剤と結合し、本剤の吸収を遅滞あるいは減少させるおそれがある。 |
|---|
制酸剤
水酸化アルミニウムゲル等 | 本剤の作用を減弱するおそれがある。 | アルミニウムを含有する制酸剤は、本剤を吸着し、本剤の吸収を阻害するおそれがある。 |
|---|
脂質低下剤
クロフィブラート等 | 本剤をコレステロール胆石溶解の目的で使用する場合は、本剤の作用を減弱するおそれがある。 | クロフィブラートは胆汁中へのコレステロール分泌を促進するため、コレステロール胆石形成が促進されるおそれがある。 |
|---|
副作用
副作用等発現状況の概要
本剤は使用成績調査等の副作用発現頻度が明確となる調査を実施していない。
重大な副作用(頻度不明)
間質性肺炎
発熱、咳嗽、呼吸困難、胸部X線異常を伴う間質性肺炎があらわれることがあるので、このような症状があらわれた場合には、投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
その他の副作用
消化器
頻度不明
下痢、悪心、食欲不振、便秘、胸やけ、胃不快感、腹痛、腹部膨満、嘔吐
過敏症
頻度不明
そう痒、発疹注)、蕁麻疹注)、紅斑(多形滲出性紅斑等)注)等
肝臓
頻度不明
AST(GOT)上昇、ALT(GPT)上昇、Al-P上昇、ビリルビン上昇、γ-GTP上昇
その他
頻度不明
全身けん怠感、めまい、白血球減少
注) このような症状があらわれた場合には、投与を中止するなど適切な処置を行うこと。
高齢者への投与
一般に高齢者では生理機能が低下しているので、用量に注意して投与すること。
妊婦、産婦、授乳婦等への投与
妊婦又は妊娠している可能性のある婦人には投与しないことが望ましい。[動物実験(ラット)で妊娠前及び妊娠初期の大量(2,000mg/kg/日)投与により胎児毒性(胎児吸収)が報告されている]
適用上の注意
薬剤交付時:
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。(PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することが報告されている)
薬物動態
生物学的同等性試験1)
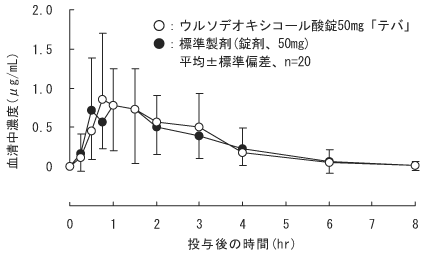
●ウルソデオキシコール酸錠50mg「テバ」
ウルソデオキシコール酸錠50mg「テバ」と標準製剤を、クロスオーバー法によりそれぞれ2錠(ウルソデオキシコール酸として100mg)健康成人男子に絶食単回経口投与して血清中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された。
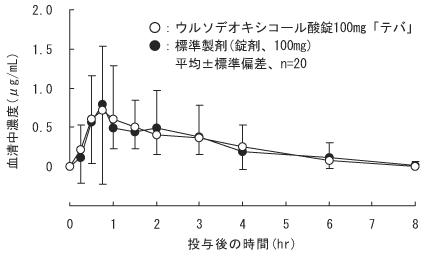
●ウルソデオキシコール酸錠100mg「テバ」
ウルソデオキシコール酸錠100mg「テバ」と標準製剤を、クロスオーバー法によりそれぞれ1錠(ウルソデオキシコール酸として100mg)健康成人男子に絶食単回経口投与して血清中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された。
溶出性2)
ウルソデオキシコール酸錠50mg「テバ」及びウルソデオキシコール酸錠100mg「テバ」の溶出性は、日本薬局方に定められた規格に適合していることが確認されている。
薬物動態の表
ウルソデオキシコール酸錠50mg「テバ」 絶食単回経口投与
薬物動態パラメータ (平均±標準偏差、n=20)
| | 投与量
(mg) | AUC0-8
(μg・hr/mL) | Cmax
(μg/mL) | Tmax
(hr) | T1/2
(hr) |
| ウルソデオキシコール酸錠50mg「テバ」 | 100 | 2.33±1.11 | 1.26±0.75 | 1.3±0.7 | 2.3±1.8 |
| 標準製剤(錠剤、50mg) | 100 | 2.30±1.16 | 1.18±0.75 | 1.2±0.8 | 3.4±5.6 |
ウルソデオキシコール酸錠100mg「テバ」 絶食単回経口投与
薬物動態パラメータ (平均±標準偏差、n=20)
| | 投与量
(mg) | AUC0-8
(μg・hr/mL) | Cmax
(μg/mL) | Tmax
(hr) | T1/2
(hr) |
| ウルソデオキシコール酸錠100mg「テバ」 | 100 | 2.08±1.10 | 1.18±0.87 | 1.4±0.9 | 2.2±2.0 |
| 標準製剤(錠剤、100mg) | 100 | 2.03±1.12 | 1.16±0.71 | 1.6±1.3 | 1.8±1.7 |
薬効薬理
利胆作用(肝胆汁流量及びビリルビン排泄量の増加)、肝血流量増加作用、脂肪吸収促進作用、胆汁のコレステロール不飽和化作用、液晶形成作用(胆汁中に多成分系の液晶が認められるようになる)、コレステロールの腸管吸収抑制作用がある。また、動物実験により、血清コレステロール低下作用、リパーゼ活性の促進作用、膵液分泌促進作用、胆石生成抑制作用、肝HMG-CoA reductase活性抑制及びcholesterol 7α-hydroxylase活性上昇作用が認められている。3)
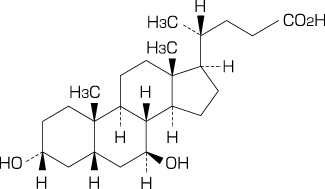
有効成分に関する理化学的知見
一般名
ウルソデオキシコール酸(Ursodeoxycholic Acid)
化学名
3α,7β-Dihydroxy-5β-cholan-24-oic acid
分子式
C24H40O4
分子量
392.57
性 状
白色の結晶又は粉末で、味は苦い。メタノール、エタノール(99.5)又は酢酸(100)に溶けやすく、水にほとんど溶けない。
構造式
取扱い上の注意
安定性試験結果の概要4)
加速試験(40℃、相対湿度75%、6ヵ月)の結果、ウルソデオキシコール酸錠50mg「テバ」及びウルソデオキシコール酸錠100mg「テバ」は通常の市場流通下において3年間安定であることが推測された。
包装
**●ウルソデオキシコール酸錠50mg「テバ」
PTP包装:100錠(10錠×10)、1,000錠(10錠×100)
●ウルソデオキシコール酸錠100mg「テバ」
*PTP包装:100錠(10錠×10)、1,000錠(10錠×100)
バラ包装:1,200錠
主要文献
1
武田テバファーマ(株)社内資料(生物学的同等性試験)
2
武田テバファーマ(株)社内資料(溶出試験)
3
**第十七改正日本薬局方解説書
4
武田テバファーマ(株)社内資料(安定性試験)
文献請求先・製品情報お問い合わせ先
*主要文献欄に記載の文献・社内資料は下記にご請求下さい。
武田テバファーマ株式会社 武田テバDIセンター
〒453-0801 名古屋市中村区太閤一丁目24番11号
TEL 0120-923-093
受付時間 9:00〜17:30(土日祝日・弊社休業日を除く)
製造販売業者等の氏名又は名称及び住所
*販売
武田薬品工業株式会社
大阪市中央区道修町四丁目1番1号
*製造販売元
武田テバファーマ株式会社
名古屋市中村区太閤一丁目24番11号

 6.0
6.0 70
70 2.2
2.2
 8.0
8.0 140
140 2.5
2.5