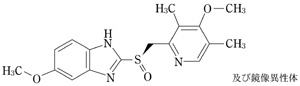
| 剤形 | 直径(mm) | 重量(mg) | 厚さ(mm) | 性状 | **識別コード | **外形 |
| 腸溶性フィルムコーティング錠 | 6.2 | 約97 | 3.5 | 白色 | MED 899 |  |
| 剤形 | 直径(mm) | 重量(mg) | 厚さ(mm) | 性状 | **識別コード | **外形 |
| 腸溶性フィルムコーティング錠 | 7.2 | 約139 | 3.6 | 白色 | MED 900 |  |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| アタザナビル硫酸塩 (レイアタッツ) | アタザナビル硫酸塩の作用を減弱するおそれがある。 | 本剤の胃酸分泌抑制作用によりアタザナビル硫酸塩の溶解性が低下し、アタザナビルの血中濃度が低下することがある。 |
| リルピビリン塩酸塩 (エジュラント) | リルピビリン塩酸塩の作用を減弱するおそれがある。 | 本剤の胃酸分泌抑制作用によりリルピビリン塩酸塩の吸収が低下し、リルピビリンの血中濃度が低下することがある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| ジアゼパム フェニトイン シロスタゾール | これらの薬剤の作用を増強することがある。 | 本剤は主に肝臓のチトクロームP450系薬物代謝酵素CYP2C19で代謝されるため、本剤と同じ代謝酵素で代謝される薬物の代謝、排泄を遅延させるおそれがある。 |
| ワルファリン | 抗凝血作用を増強し、出血に至るおそれがある。プロトロンビン時間国際標準比(INR)値等の血液凝固能の変動に十分注意しながら投与すること。 | 本剤は主に肝臓のチトクロームP450系薬物代謝酵素CYP2C19で代謝されるため、本剤と同じ代謝酵素で代謝される薬物の代謝、排泄を遅延させるおそれがある。 |
| タクロリムス水和物 | タクロリムスの血中濃度が上昇することがある。 | 相互作用の機序は不明である。 |
| ジゴキシン メチルジゴキシン | これらの薬剤の作用を増強することがある。 | 本剤の胃酸分泌抑制作用によりジゴキシンの加水分解が抑制され、ジゴキシンの血中濃度が上昇することがある。 |
| イトラコナゾール | イトラコナゾールの作用を減弱することがある。 | 本剤の胃酸分泌抑制作用によりイトラコナゾールの溶解性が低下し、イトラコナゾールの血中濃度が低下することがある。 |
| チロシンキナーゼ阻害剤 ゲフィチニブ エルロチニブ | これらの薬剤の血中濃度が低下することがある。 | 本剤の胃酸分泌抑制作用によりこれらの薬剤の溶解性が低下し、吸収が低下することがある。 |
| ボリコナゾール | 本剤のCmax及びAUCが増加したとの報告がある。 | ボリコナゾールは本剤の代謝酵素(CYP2C19及びCYP3A4)を阻害することが考えられる。 |
| ネルフィナビルメシル酸塩 | ネルフィナビルの血中濃度が低下するおそれがある。 | 相互作用の機序は不明である。 |
| サキナビルメシル酸塩 | サキナビルの血中濃度が上昇するおそれがある。 | 相互作用の機序は不明である。 |
| クロピドグレル硫酸塩 | クロピドグレル硫酸塩の作用を減弱するおそれがある。 | 本剤がCYP2C19を阻害することにより、クロピドグレル硫酸塩の活性代謝物の血中濃度が低下する。 |
| セイヨウオトギリソウ(St.John's Wort,セント・ジョーンズ・ワート)含有食品 | 本剤の代謝が促進され血中濃度が低下するおそれがある。 | セイヨウオトギリソウが本剤の代謝酵素(CYP2C19及びCYP3A4)を誘導することが考えられる。 |
| メトトレキサート | メトトレキサートの血中濃度が上昇することがある。高用量のメトトレキサートを投与する場合は、一時的に本剤の投与を中止することを考慮すること。 | 相互作用の機序は不明である。 |
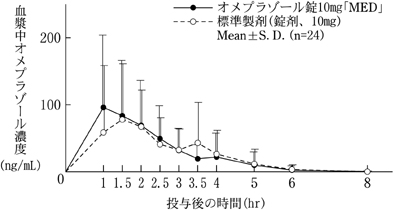
| Cmax(ng/mL) | Tmax(hr) | AUC0-8hr(ng・hr/mL) | |
| オメプラゾール錠10mg「MED」 | 172±86 | 1.8±0.9 | 229±113 |
| 標準製剤(錠剤、10mg) | 158±78 | 2.0±1.1 | 211±112 |
| Cmax(ng/mL) | Tmax(hr) | AUC0-8hr(ng・hr/mL) | |
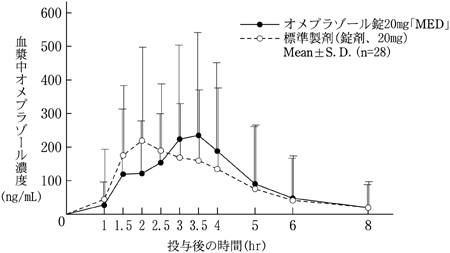
| オメプラゾール錠20mg「MED」 | 402±293 | 2.6±1.0 | 770±859 |
| 標準製剤(錠剤、20mg) | 413±284 | 2.3±0.8 | 748±869 |