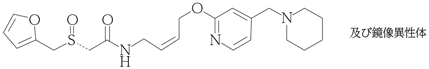
1
社内資料:生物学的同等性試験(錠10mg)
2
春木左千夫 他:薬理と治療. 1995;23(11):3049-3059
3
古橋三義 他:透析会誌. 2002;35(1):35-42
4
社内資料:生物学的同等性試験(錠5mg)
5
第十八改正 日本薬局方解説書. 廣川書店. 2021:C5981-C5984
H2受容体拮抗剤
1錠 10.1円
有効成分 | ラフチジン(日局) 5mg |
|---|---|
添加剤 | 乳糖水和物、結晶セルロース、トウモロコシデンプン、ヒドロキシプロピルセルロース、クロスカルメロースナトリウム、軽質無水ケイ酸、ステアリン酸マグネシウム、ヒプロメロース、酸化チタン、マクロゴール6000、タルク、カルナウバロウ |
有効成分 | ラフチジン(日局) 10mg |
|---|---|
添加剤 | 乳糖水和物、結晶セルロース、トウモロコシデンプン、ヒドロキシプロピルセルロース、クロスカルメロースナトリウム、軽質無水ケイ酸、ステアリン酸マグネシウム、ヒプロメロース、酸化チタン、マクロゴール6000、タルク、カルナウバロウ |
| 剤形 | フィルムコーティング錠 |
|---|---|
| 色調 | 白色 |
| 外形 | 表面  裏面  側面  |
| 大きさ | 大きさ(直径) 5.6mm 大きさ(厚さ) 2.7mm 重量 68mg |
| 識別コード | TU 241 |
| 剤形 | フィルムコーティング錠 |
|---|---|
| 色調 | 白色 |
| 外形 | 表面  裏面  側面  |
| 大きさ | 大きさ(直径) 6.1mm 大きさ(厚さ) 2.8mm 重量 86mg |
| 識別コード | TU 242 |
0.1~5%未満 | 0.1%未満 | 頻度不明 | |
|---|---|---|---|
過敏症 | 発疹、蕁麻疹 | そう痒 | |
血液 | 白血球数増加、白血球数減少、赤血球数減少、ヘモグロビン減少、ヘマトクリット減少 | 好酸球上昇 | |
肝臓 | ALT上昇、AST上昇、Al-P上昇、γ-GTP上昇、LDH上昇、T-Bil上昇 | TTT上昇 | |
腎臓 | 尿タンパク異常 | BUN上昇 | |
精神 神経系 | 不眠、眠気 | 頭痛、めまい | 可逆性の錯乱状態、幻覚、意識障害、痙攣 |
循環器 | 熱感 | 動悸 | 顔面紅潮 |
消化器 | 便秘、下痢、嘔気・嘔吐、食欲不振 | 硬便、腹部膨満感 | 口渇 |
その他 | 血清尿酸値上昇、K低下、Cl上昇、浮腫 | 生理遅延、Na上昇 | 女性化乳房、倦怠感 |
判定パラメータ | 参考パラメータ | |||
AUC0→24hr (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | |
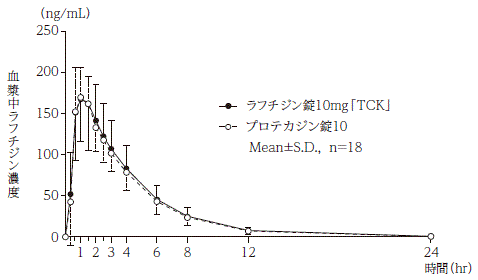
ラフチジン錠10mg「TCK」 | 792.07±244.42 | 189.54±51.35 | 1.03±0.41 | 2.66±0.61 |
プロテカジン錠10 | 759.23±198.44 | 182.36±36.17 | 0.96±0.33 | 2.61±0.59 |
Tmax (hr) | Cmax (ng/mL) | T1/2 (hr) | AUC (ng・hr/mL) | ||
健康成人(参考) | 0.8±0.1 | 174±20 | 3.30±0.39 | 793±85 | |
高齢者 | 腎機能正常 | 1.0±0.2 | 195±17 | 3.05±0.19 | 869±65 |
腎機能 低下傾向 | 1.1±0.2 | 196±23 | 2.93±0.21 | 853±113 | |
透析 患者 | 透析時 | 2.6±0.5 | 226±36 | 4.57±0.24注) | 853±128注) |
非透析時 | 0.8±0.1 | 336±40 | 6.71±0.30 (4.37±0.45)注) | 2278±306 (1264±133)注) | |