1
臼井哲夫他:薬理と治療, 1985;13(3):1325-1340
2
福島健他:薬理と治療, 1985;13(3):1341-1351
3
臼井哲夫他:薬理と治療, 1985;13(3):1353-1365
4
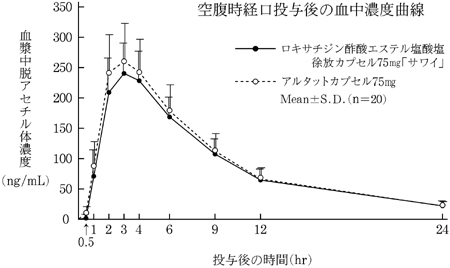
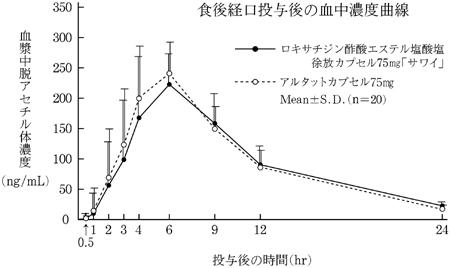
薬物動態試験、成人単回投与(アルタットカプセル:2011年1月21日承認、申請資料概要2.7.6.2)
5
長谷川吉康他:薬理と治療, 1985;13(1):85-97
6
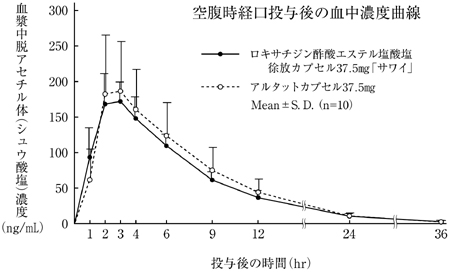
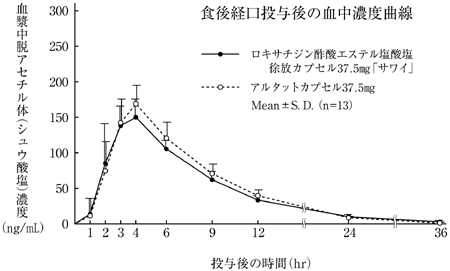
社内資料:生物学的同等性試験(カプセル37.5mg)
7
社内資料:生物学的同等性試験(カプセル75mg)
8
圷玲子他:薬理と治療, 1985;13(3):1435-1443
9
高畠利一他:薬理と治療, 1985;13(6):3377-3388
10
河西稔他:麻酔, 1986;35(1):130-138
11
岩村敏他:応用薬理, 1985;30(2):299-320
12
本間誠次郎他:応用薬理, 1985;30(3):555-563
13
薬物動態試験、小児単回投与①(アルタットカプセル:2011年1月21日承認、申請資料概要2.7.6.3)
14
薬物動態試験、小児単回投与②(アルタットカプセル:2011年1月21日承認、申請資料概要2.7.3.4)
15
浅香正博他:診療と新薬, 1985;22(5):1145-1154
16
三好秋馬他:診療と新薬, 1985;22(3):501-515
17
水島和雄他:医学と薬学, 1985;13(3):597-605
18
佐藤正伸他:新薬と臨牀, 1985;34(5):787-796
19
土屋雅春他:新薬と臨牀, 1985;34(7):1227-1238
20
川村忠夫他:基礎と臨牀, 1985;19(5):2685-2692
21
水落勝明他:臨牀と研究, 1985;62(9):3037-3046
22
福田能啓他:医学と薬学, 1985;13(5):1187-1196
23
竹本忠良他:臨床成人病, 1985;15(11):1739-1745
24
中澤慶彦他:医学と薬学, 1985;13(5):1201-1208
25
三澤正他:医学と薬学, 1985;14(4):1117-1122
26
松本興三他:新薬と臨牀, 1985;34(5):821-828
27
三好秋馬他:医学と薬学, 1988;19(2):357-370
28
三好秋馬他:診療と新薬, 1988;25(3):397-415
29
三好秋馬他:診療と新薬, 1985;22(5):1069-1089
30
三好秋馬他:診療と新薬, 1985;22(12):2897-2918
31
小山茂樹他:診療と新薬, 1988;25(3):521-531
32
浅香正博他:診療と新薬, 1988;25(5):893-902
33
三好秋馬他:診療と新薬, 1988;25(3):417-435
34
三好秋馬他:診療と新薬, 1985;22(5):1091-1110
35
三好秋馬他:診療と新薬, 1985;22(12):2919-2939
36
福富久之他:診療と新薬, 1985;22(7):1664-1672
37
関根昌子他:診療と新薬, 1985;22(6):1492-1498
38
森治樹他:診療と新薬, 1985;22(7):1673-1681
39
関口利和他:新薬と臨牀, 1985;34(7):1253-1258
40
岸清一郎他:医学と薬学, 1985;14(1):113-119
41
関口利和他:臨床医薬, 1988;4(3):461-476
42
岸清一郎他:診療と新薬, 1987;24(12):2465-2475
43
横井雅一他:診療と新薬, 1985;22(6):1574-1580
44
田中博文他:麻酔, 1985;34(12):1673-1680
45
山田達也他:診療と新薬, 1987;24(10):2023-2030
46
白濱龍興他:新薬と臨牀, 1990;39(8):1575-1583
47
小山茂樹他:診療と新薬, 1990;27(12):2363-2370
48
浅香正博他:診療と新薬, 1990;27(7):1213-1224
49
三好秋馬他:臨床医薬, 1991;7(2):413-436
50
一般臨床試験、小児(アルタットカプセル:2011年1月21日承認、申請資料概要2.7.6.5)
51
第十八改正日本薬局方解説書, 廣川書店, 2021;C-6291-6295
52
三好秋馬他:薬理と治療, 1985;13(3):1445-1453
53
三好秋馬他:薬理と治療, 1985;13(3):1455-1469
54
三好秋馬他:薬理と治療, 1985;13(3):1471-1483
55
佐藤裕一他:臨牀と研究, 1985;62(9):2967-2972
56
三好秋馬他:薬理と治療, 1985;13(3):1485-1494
57
佐伯進他:臨牀と研究, 1985;62(8):2643-2648
58
薬力学試験、小児単回投与(アルタットカプセル:2011年1月21日承認、申請資料概要2.7.6.4)
59
斉藤拓康他:Ulcer Res., 2000;27(2):132-134
60
三澤正他:医学と薬学, 1985;13(5):1175-1181
61
Ichikawa, T. et al.:Br. J. Pharmacol., 1997;122(6):1230-1236
62
高橋伸行他:薬理と治療, 1998;26(10):1701-1704
63
白土賢治他:薬理と治療, 1985;13(3):1413-1420
64
川野淳他:薬理と治療, 1985;13(3):1429-1433
65
Mikami, T.:薬理と治療, 1988;16(9):3743-3748
66
Shiratsuchi, K. et al.:Arch. int. Pharmacodyn. Ther., 1988;294:295-304
67
布施宏昭他:薬理と治療, 1990;18(8):2965-2972