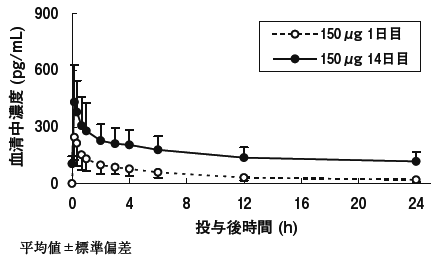
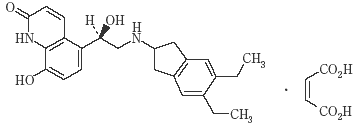
1
社内資料:日本人COPD患者を対象とした用量設定試験(2011年7月1日承認、CTD2.7.2-2.2.1.1)[20113201]
2
Khindri S., et al.:BMC Pulm. Med. 2011;11:31[20123563]
3
社内資料:吸入投与時の絶対的バイオアベイラビリティの評価(2011年7月1日承認、CTD2.7.1-2.2.1.1)[20113030]
4
社内資料:吸入投与時と経口投与時のバイオアベイラビリティの比較(2011年7月1日承認、CTD2.7.1-2.2.1.2)[20113031]
5
社内資料:血漿及び血清中蛋白結合率(2011年7月1日承認、CTD2.6.4-4.1)[20113032]
6
社内資料:吸収、代謝及び排泄の検討(2011年7月1日承認、CTD2.7.2-2.1.2.5)[20113033]
7
社内資料:代謝酵素の同定(2011年7月1日承認、CTD2.6.4-5.2)[20113034]
8
社内資料:Caco-2細胞単層膜を用いた膜透過性試験(2011年7月1日承認、CTD2.6.4-7.2)[20113035]
9
社内資料:日本人及び外国人健康成人を対象とした単回投与試験(2011年7月1日承認、CTD2.7.2-2.1.1.1)[20113036]
10
社内資料:肝機能障害が薬物動態に及ぼす影響(2011年7月1日承認、CTD2.7.2-2.1.2.6)[20113040]
11
社内資料:UGT1A1変異型の薬物動態(2011年7月1日承認、CTD2.7.2-2.1.2.7)[20113041]
12
社内資料:エリスロマイシンとの薬物間相互作用(2011年7月1日承認、CTD2.7.2-2.1.2.10)[20113039]
13
社内資料:ベラパミルとの薬物間相互作用(2011年7月1日承認、CTD2.7.2-2.1.2.9)[20113038]
14
社内資料:リトナビルとの薬物間相互作用[20134491]
15
社内資料:ケトコナゾールとの薬物間相互作用(2011年7月1日承認、CTD2.7.2-2.1.2.8)[20113037]
16
社内資料:COPD患者(日本を含むアジア地域)を対象とした二重盲検比較試験(2011年7月1日承認、CTD2.7.6-5.1.2)[20113202]
17
社内資料:COPD患者(日本)を対象とした長期投与試験(2011年7月1日承認、CTD2.7.6-5.2.1)[20113203]
18
社内資料:アドレナリンβ受容体に対するインダカテロールのIn vitroにおける選択性及び機能活性(2011年7月1日承認、CTD2.4-3.1.1)[20113374]
19
社内資料:覚醒下モルモットにおけるインダカテロールの作用持続の検討(2011年7月1日承認、CTD2.4-3.1.4)[20113370]
20
社内資料:アカゲザルを用いたβ刺激剤のメサコリン誘発気道収縮に対する抑制作用(2011年7月1日承認、CTD2.4-3.1.4)[20113371]





 IDL 150
IDL 150