1
黒住正雄他:応用薬理.1979;17(5):691-712
2
河野一弥他:応用薬理.1979;17(5):713-732
3
Jack, D. et al.:Toxicology.1983;27:315-320
4
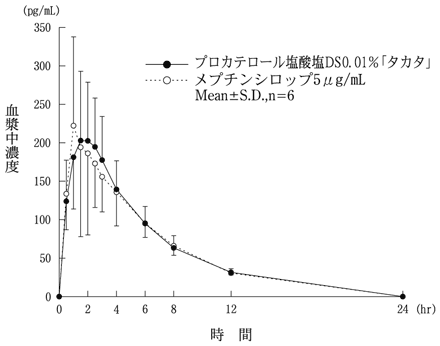
社内資料:生物学的同等性試験(プロカテロール塩酸塩DS0.01%「タカタ」)
5
Himori, N. et al.:Br J Pharmac.1977;61(1):9-17
6
Yamashita, S. et al.:J Pharm Pharmac.1978;30(5):273-279